永續社 www.epa.url.tw 林雨莊
永續社 www.epa.url.tw 林雨莊免疫系統是動物體內負責保護身體免受外來病原體(如細菌、病毒、真菌和寄生蟲)侵害的防禦系統。它由多種細胞、器官和分子組成,這些要素相互協作,幫助動物識別、攻擊並消滅外來的威脅,從而維持體內穩定。免疫系統的運作包括了先天性免疫和後天性免疫兩大部分,它們共同保護動物免於感染並協助身體恢復健康。
先天性免疫是免疫系統的第一道防線,具有即時反應的能力,能夠快速抵禦外來病原體。這一部分免疫系統不針對特定病原體,而是通過辨識病原體的共有特徵來啟動免疫反應。皮膚和黏膜是先天免疫的物理屏障,它們能有效阻擋病原體進入體內。當病原體穿透這些屏障進入體內,巨噬細胞和中性球等吞噬細胞會迅速發揮作用,這些細胞能夠吞噬並消化外來微生物,從而阻止感染擴散。先天免疫系統還包括補體系統,這是一組在血液中循環的蛋白質,能夠標記病原體,促進其被吞噬細胞識別和摧毀。
發炎反應是先天免疫的另一種重要機制,當身體受到感染或組織損傷時,發炎反應會導致受感染部位的血管擴張,使更多的免疫細胞和補體蛋白到達受損區域,從而加速修復和抵禦病原體。典型的發炎症狀包括紅腫、熱痛,這是免疫細胞大量聚集並活躍工作的結果。
後天性免疫又稱適應性免疫,是免疫系統的第二道防線,針對特定病原體展開更加精確的攻擊。與先天免疫不同,後天免疫具有記憶功能,能夠在再次遇到同一病原體時產生更強、更快速的反應。後天免疫主要依賴於淋巴細胞,包括T細胞和B細胞。T細胞在免疫反應中扮演多重角色,某些T細胞(如輔助性T細胞)能夠激活其他免疫細胞,而另一些T細胞(如細胞毒性T細胞)則直接攻擊被病原體感染的細胞。B細胞則負責產生抗體,這些抗體能夠特異性地結合病原體,標記其進行摧毀。
抗體是一種由B細胞製造的蛋白質,其功能是識別並中和外來病原體。當抗體與病原體結合後,病原體會被吞噬細胞識別並摧毀,或者直接被抗體中和,使其失去感染能力。B細胞在首次接觸病原體後需要一定時間才能生成抗體,但在未來再次遇到相同病原體時,記憶B細胞能夠迅速生成大量的抗體,這使得後天免疫的反應速度大大加快,並且更加有效。
免疫系統的調控非常複雜,依賴於免疫細胞之間的協同合作。淋巴結、脾臟和骨髓等免疫器官是免疫細胞生成、成熟和活化的場所。淋巴結是過濾淋巴液的器官,當淋巴液攜帶病原體經過時,免疫細胞會在淋巴結中被激活,開始免疫反應。脾臟則過濾血液,能夠清除血液中的病原體和損傷細胞。骨髓是產生淋巴細胞和其他血細胞的主要場所。
免疫系統還具有自我區分的能力,它能夠識別哪些是外來病原體,哪些是自身的細胞,從而避免攻擊自身組織。然而,當這一識別機制失效時,免疫系統可能會攻擊自身細胞,這會導致自身免疫性疾病,如紅斑性狼瘡、類風濕性關節炎等。
免疫系統不僅在對抗感染中發揮作用,還在癌症防禦中具有關鍵角色。免疫細胞能夠識別和摧毀異常增生的癌細胞,這是稱為免疫監視的過程。當癌細胞逃避免疫系統的監視時,可能會導致癌症的發展。近年來,免疫療法已經成為癌症治療中的一個新興領域,通過增強免疫系統的能力來識別並攻擊癌細胞,達到治療的效果。
疫苗是後天免疫的一個應用,它的基本原理是通過模擬病原體的部分特徵來訓練免疫系統,使其生成記憶B細胞和T細胞,當實際病原體入侵時,免疫系統能夠快速做出反應。這一技術已被廣泛應用於對抗許多傳染病,如天花、麻疹和流感。
雖然免疫系統強大且複雜,但它也容易受到各種因素的影響。例如,長期壓力、營養不良或缺乏睡眠都可能削弱免疫系統,使人更容易受到感染。年齡增長也是影響免疫功能的重要因素,隨著年齡的增加,免疫系統的反應會變得較為遲緩,這也是老年人更易受到感染和患病的原因之一。
免疫系統是維持生命健康的重要屏障,它透過先天和後天免疫的雙重防禦,保護動物免受外來病原體的侵害,並在體內維持穩定的生理狀態。這個系統的協調運作不僅能對抗疾病,還能調控身體的自我修復和適應能力。
免疫系統對於生物體的生存和健康至關重要,它是機體抵抗外來病原體入侵和維持內環境穩定的重要防線。
首先,免疫系統是機體抵抗各種病原微生物的主要武器。在我們周圍的環境中,存在著大量的細菌、病毒、真菌和寄生蟲等微生物,它們中的許多都可能對人體造成傷害。免疫系統能夠識別並消滅這些潛在的威脅,防止它們在體內繁殖和擴散,從而避免感染性疾病的發生。例如,當我們接觸到流感病毒時,免疫系統會迅速作出反應,產生抗體並激活特定的免疫細胞來清除病毒,使我們能夠抵抗疾病或更快地從疾病中恢復。
其次,免疫系統在維持機體內環境穩定方面發揮著重要作用。它不僅能識別外來的病原體,還能識別體內異常或衰老的細胞,如癌細胞或受損的組織細胞。通過清除這些異常細胞,免疫系統幫助維持組織的健康和正常功能。例如,自然殺手細胞(Natural Killer Cells)能夠識別並殺死被病毒感染的細胞或癌變的細胞,防止它們進一步擴散和危害機體。
此外,免疫系統具有"記憶"功能,這對於長期抵抗特定病原體至關重要。當機體首次接觸某種病原體時,免疫系統會產生特異性的免疫反應,並形成免疫記憶。這種記憶使得在再次遇到同一病原體時,免疫系統能夠更快速、更有效地作出反應。這一機制是疫苗接種的基礎,通過接種減毒或死亡的病原體,我們可以激活免疫系統產生記憶,從而在未來遇到實際病原體時能夠迅速做出防禦反應。
免疫系統還在過敏反應和自身免疫疾病中扮演著關鍵角色。雖然這些情況下免疫系統的反應可能對機體造成傷害,但研究這些現象有助於我們更深入地理解免疫系統的工作機制,並為相關疾病的治療提供新的思路。
免疫系統的重要性體現在它為機體提供了全面的保護網絡,從日常抵抗常見病原體,到預防重大疾病的發生,再到維持機體的整體健康,免疫系統無時無刻不在發揮著其至關重要的作用。深入理解免疫系統的工作原理,不僅有助於我們更好地保護自身健康,還為開發新的治療方法和預防策略提供了重要基礎。
固有免疫反應是人體免疫系統的第一道防線,它為機體提供了快速而非特異性的防禦機制,用以抵禦各種潛在的病原體入侵。與適應性免疫反應不同,固有免疫反應不需要事先接觸病原體就能發揮作用,因此能夠在感染的最初階段迅速做出反應。
固有免疫系統的組成元素包括物理屏障、化學屏障、細胞成分和體液成分。這些元素共同協作,形成了一個複雜而高效的防禦網絡。
物理屏障是固有免疫系統的最外層防線。皮膚是最大的物理屏障,它不僅能阻擋大多數病原體的入侵,還能分泌具有殺菌作用的物質。除了皮膚,黏膜組織也是重要的物理屏障,如呼吸道、消化道和泌尿生殖道的黏膜。這些黏膜不僅能阻擋病原體,還能通過分泌黏液來捕獲和清除微生物。
化學屏障是固有免疫系統的另一個重要組成部分。人體會分泌各種具有抗菌作用的化學物質,如皮膚表面的汗液和皮脂中含有的乳酸和脂肪酸,它們能夠抑制許多微生物的生長。胃酸是另一個重要的化學屏障,其高酸性環境能夠殺死大多數隨食物進入的病原體。此外,唾液、淚液和其他體液中含有的溶菌酶(lysozyme)也能夠破壞某些細菌的細胞壁。
細胞成分是固有免疫反應中的主力軍。其中最重要的是各種白血球,包括中性粒細胞、巨噬細胞、樹突細胞和自然殺手細胞等。這些細胞能夠識別和吞噬入侵的病原體,並分泌各種炎症介質來協調免疫反應。
中性粒細胞是最豐富的循環白血球,它們能夠快速移動到感染部位,吞噬並殺死病原體。巨噬細胞則主要分佈在組織中,不僅能吞噬病原體,還能清除死亡的細胞和其他碎片。樹突細胞是連接固有免疫和適應性免疫的橋樑,它們能夠捕獲病原體並將其抗原呈遞給T細胞,從而激活適應性免疫反應。
自然殺手細胞(Natural Killer Cells)是一種特殊的淋巴細胞,它們能夠識別並殺死被病毒感染的細胞或腫瘤細胞。這種能力使得自然殺手細胞在抵抗病毒感染和腫瘤發生中發揮重要作用。
體液成分是固有免疫系統的另一個關鍵部分。其中最重要的是補體系統(Complement System),它由一系列蛋白質組成,這些蛋白質能夠級聯激活,形成一個強大的防禦系統。補體系統不僅能直接殺死某些病原體,還能增強吞噬作用,促進炎症反應,並協助適應性免疫反應的啟動。
此外,干擾素(Interferons)是另一類重要的體液成分。當細胞被病毒感染時,它們會分泌干擾素,這種物質能夠激活周圍細胞的抗病毒狀態,阻止病毒的擴散。干擾素還能增強自然殺手細胞和巨噬細胞的活性,從而提高整體的抗病毒能力。
固有免疫反應的一個重要特徵是其快速性。當病原體入侵時,固有免疫系統能夠在幾分鐘到幾小時內做出反應。這種快速反應主要依賴於模式識別受體(Pattern Recognition Receptors, PRRs)。這些受體能夠識別病原體相關分子模式(Pathogen-Associated Molecular Patterns, PAMPs),這些模式是許多病原體所共有的分子結構。
最為人所知的模式識別受體是脂多糖受體(Toll-Like Receptors, TLRs)家族。不同的TLRs能夠識別不同類型的PAMPs,如細菌的脂多糖、病毒的雙鏈RNA等。當TLRs識別到相應的PAMPs時,會激活細胞內的信號通路,導致炎症介質的產生和免疫細胞的活化。
炎症反應是固有免疫反應的一個重要組成部分。當組織受到損傷或感染時,會釋放出各種炎症介質,如組胺、前列腺素和細胞因子等。這些物質能夠引起局部血管擴張,增加血管通透性,並吸引更多的免疫細胞來到感染部位。這就是我們常見的炎症症狀:紅、腫、熱、痛。雖然這些症狀可能會讓人感到不適,但它們實際上是機體對抗感染的重要機制。
固有免疫反應雖然快速有效,但也有其局限性。首先,它是非特異性的,無法針對特定的病原體產生精確的攻擊。其次,它不具備免疫記憶,每次遇到相同的病原體都會做出相同的反應,無法像適應性免疫那樣隨著多次接觸而變得更加有效。
然而,固有免疫反應的重要性不僅在於其直接的防禦作用,還在於它為適應性免疫反應的啟動創造了條件。固有免疫細胞,特別是樹突細胞,在捕獲和處理病原體後,能夠將抗原呈遞給T細胞,從而激活適應性免疫反應。此外,固有免疫反應產生的炎症環境和細胞因子也能促進適應性免疫細胞的增殖和分化。
值得注意的是,固有免疫系統還具有一定的可塑性和"訓練"能力。近年來的研究表明,某些固有免疫細胞在經歷特定刺激後,能夠產生一種稱為"訓練性免疫"(Trained Immunity)的現象。這種現象使得這些細胞在再次遇到相同或類似刺激時,能夠做出更強烈、更有效的反應。這一發現打破了固有免疫完全缺乏記憶能力的傳統認知,為我們理解和利用固有免疫系統開闢了新的視野。
固有免疫反應還與其他生理系統密切相關。例如,神經系統和內分泌系統都能影響固有免疫反應的強度和持續時間。壓力、睡眠質量、營養狀況等因素都可能通過這些系統間的相互作用影響固有免疫功能。這種複雜的相互關係也解釋了為什麼生活方式和心理狀態會影響一個人的免疫力。
固有免疫反應作為人體免疫系統的第一道防線,在抵禦病原體入侵、維持機體健康方面發揮著至關重要的作用。它不僅能夠快速有效地對抗各種潛在威脅,還為適應性免疫反應的啟動創造條件,是一個複雜而高效的防禦系統。深入理解固有免疫反應的機制和特點,不僅有助於我們更好地保護自身健康,還為開發新的治療方法和預防策略提供了重要的理論基礎。
物理與化學屏障是人體固有免疫系統的重要組成部分,它們共同構成了抵禦外來病原體入侵的第一道防線。這些屏障不僅能夠阻擋大多數微生物的進入,還能通過各種機制主動清除或殺死潛在的威脅。物理與化學屏障的協同作用為機體提供了全面而有效的保護。
皮膚是人體最大的物理屏障,它覆蓋了整個體表,為內部器官提供了堅實的保護。皮膚由多層細胞組成,其最外層是角質層,由死去的角質細胞和角蛋白組成。這種結構使得皮膚具有極強的防水性和抗穿透性,能夠有效阻擋大多數微生物的入侵。此外,皮膚表面的酸性環境(pH約為4.5-6.5)也不利於許多微生物的生存。
皮膚的物理屏障功能還得到了其他機制的補充。例如,皮膚表面的皮脂腺會分泌油脂,這些油脂不僅能保持皮膚的柔軟性,還含有抗菌物質如游離脂肪酸,能夠抑制某些微生物的生長。汗腺分泌的汗液也具有類似作用,不僅能通過蒸發帶走熱量,還含有溶菌酶(lysozyme)等抗菌物質。
值得注意的是,皮膚表面還存在著大量的共生微生物,這些微生物構成了皮膚微生態系統。它們不僅不會對人體造成危害,反而能夠通過競爭效應抑制潛在病原體的生長,為皮膚提供額外的保護。
除了皮膚,人體的黏膜也是重要的物理屏障。黏膜覆蓋了呼吸道、消化道和泌尿生殖道等與外界直接接觸的內部表面。黏膜表面的上皮細胞緊密相連,形成了一道物理屏障。這些細胞還能分泌黏液,這層黏液不僅能捕獲微生物和異物,還含有多種抗菌物質。
在呼吸道中,纖毛上皮細胞的存在進一步增強了物理屏障的功能。這些細胞表面的纖毛能夠不斷擺動,將黏液層中捕獲的微生物和異物向上輸送,最終通過咳嗽或吞嚥排出體外。這種被稱為黏液纖毛清除系統(mucociliary clearance system)的機制,能夠有效清除吸入的大部分微生物和顆粒物。
消化道的物理屏障功能則更為複雜。口腔中的唾液不僅能潤滑食物,還含有溶菌酶等抗菌物質。食道的蠕動運動能夠將食物和可能的病原體快速輸送到胃部。胃部強酸性的環境(pH約為1.5-3.5)能夠殺死大多數隨食物進入的微生物。小腸和大腸的黏膜則覆蓋著一層厚厚的黏液,這層黏液不僅能阻擋微生物直接接觸腸道上皮細胞,還含有多種抗菌肽。
泌尿生殖道的物理屏障同樣重要。尿道的定期沖刷作用能夠清除大部分可能入侵的微生物。陰道中的乳酸桿菌能夠產生乳酸,維持酸性環境,抑制其他微生物的生長。
化學屏障是物理屏障的重要補充,它們共同構成了一個更為全面的防禦網絡。許多體液和分泌物都含有化學屏障成分,這些成分能夠直接殺死或抑制微生物的生長。
溶菌酶是最廣泛存在的化學屏障成分之一,它存在於唾液、淚液、鼻涕、汗液等多種體液中。溶菌酶能夠破壞某些細菌的細胞壁,導致細菌溶解死亡。這種酶對革蘭氏陽性細菌特別有效。
另一類重要的化學屏障成分是抗菌肽(antimicrobial peptides)。這是一類結構多樣的小分子蛋白質,能夠通過多種機制殺死或抑制微生物。例如,人體表皮中產生的防禦素(defensins)和棘皮素(cathelicidins)能夠破壞細菌的細胞膜,導致細菌死亡。這些抗菌肽不僅能夠直接殺死微生物,還能增強其他免疫細胞的功能,在固有免疫和適應性免疫之間發揮橋樑作用。
胃酸是另一個強大的化學屏障。胃壁細胞分泌的鹽酸使胃內pH降低到1.5-3.5,這種強酸性環境能夠殺死大多數隨食物進入的微生物。雖然某些細菌如幽門螺旋桿菌能夠在這種環境中生存,但對大多數病原體胃酸是一個難以逾越的屏障。
膽汁也具有重要的化學屏障作用。膽汁中的膽鹽不僅能乳化脂肪,還能破壞某些細菌的細胞膜。此外,膽汁的鹼性還能中和從胃部進入小腸的酸性物質,為消化酶創造適宜的工作環境。
補體系統(complement system)是另一個重要的化學屏障。雖然補體系統主要作為體液免疫的一部分發揮作用,但它的某些組分也存在於黏膜表面,能夠直接攻擊入侵的微生物。補體系統不僅能夠直接裂解某些細菌,還能增強吞噬細胞的功能,並參與炎症反應的調節。
干擾素(interferons)是一類重要的抗病毒蛋白,也可以被視為化學屏障的一部分。當細胞被病毒感染時,會產生干擾素並釋放到周圍環境中。這些干擾素能夠被鄰近細胞吸收,誘導這些細胞進入抗病毒狀態,從而阻止病毒的進一步擴散。
值得注意的是,物理屏障和化學屏障並非完全分開的系統,它們常常協同工作,互相增強對方的作用。例如,皮膚的物理屏障功能就得到了皮脂中抗菌物質的化學屏障支持。同樣,呼吸道黏膜的物理屏障作用也得到了黏液中溶菌酶等化學物質的增強。
此外,物理和化學屏障還與其他免疫系統組分有密切的聯繫。例如,當物理屏障被破壞時,會立即觸發炎症反應,吸引免疫細胞到達受損部位。同時,一些化學屏障成分如抗菌肽還能夠調節適應性免疫反應,促進T細胞和B細胞的活化。
然而,物理和化學屏障也有其局限性。某些病原體已經進化出了突破這些屏障的機制。例如,某些病毒能夠直接穿透黏膜細胞,而某些細菌則能夠在極端pH環境下生存。此外,過度的物理或化學屏障反應有時反而會對機體造成傷害,如過度的皮膚角質化或胃酸分泌過多。
物理與化學屏障作為人體免疫系統的第一道防線,在抵禦外來病原體入侵方面發揮著至關重要的作用。它們不僅能夠阻擋大多數微生物的進入,還能主動清除或殺死潛在的威脅。深入理解這些屏障的工作機制,不僅有助於我們更好地保護自身健康,還為開發新的預防和治療策略提供了重要的理論基礎。例如,增強皮膚屏障功能的護膚品、模仿抗菌肽結構的新型抗生素、以及通過調節腸道微生態來增強腸道屏障功能的益生菌產品等,都是基於對物理和化學屏障深入理解而開發的應用。
病原識別是免疫系統發揮作用的關鍵起點,它使得免疫系統能夠區分自身和非自身成分,並對潛在的威脅做出適當的反應。在固有免疫系統中,病原識別主要依賴於一系列特化的受體,這些受體能夠識別病原體上的特定分子模式。
模式識別受體(Pattern Recognition Receptors, PRRs)是固有免疫系統中最重要的病原識別工具。這些受體能夠識別病原體相關分子模式(Pathogen-Associated Molecular Patterns, PAMPs),這些模式是許多病原體所共有的分子結構。PAMPs通常是病原體生存所必需的分子,因此在進化過程中高度保守,這使得PRRs能夠識別廣泛的病原體。
脂多糖受體(Toll-Like Receptors, TLRs)是最為人所知的PRRs家族。人類至少有10種不同的TLRs,每種都能識別特定類型的PAMPs。例如,TLR4能夠識別革蘭氏陰性細菌細胞壁上的脂多糖(Lipopolysaccharide, LPS),TLR3能夠識別病毒的雙鏈RNA,而TLR5則能識別細菌的鞭毛蛋白。當TLRs識別到相應的PAMPs時,會激活細胞內的信號通路,導致炎症介質的產生和免疫細胞的活化。
TLRs的分佈和位置也與其功能密切相關。某些TLRs,如TLR1、TLR2、TLR4、TLR5和TLR6,主要位於細胞表面,用於識別細菌和真菌的細胞壁成分。而另一些TLRs,如TLR3、TLR7、TLR8和TLR9,則主要位於細胞內的內體膜上,用於識別病毒的核酸。這種分佈使得免疫系統能夠對不同類型的病原體做出適當的反應。
除了TLRs,還有其他幾類重要的PRRs。核苷酸結合寡聚化結構域樣受體(NOD-Like Receptors, NLRs)是一類主要位於細胞質中的PRRs。它們能夠識別細胞內的各種PAMPs和危險相關分子模式(Danger-Associated Molecular Patterns, DAMPs)。例如,NOD1和NOD2能夠識別細菌細胞壁的肽聚糖片段,而NLRP3則能夠識別多種刺激,包括細菌毒素、尿酸晶體等。NLRs的激活可以導致炎症小體(inflammasome)的形成,進而引發強烈的炎症反應。
類RIG-I受體(RIG-I-Like Receptors, RLRs)是另一類重要的PRRs,主要用於識別病毒感染。RIG-I和MDA5是兩個主要的RLRs,它們能夠識別病毒複製過程中產生的雙鏈RNA。當這些受體被激活時,會引發一系列信號級聯反應,最終導致干擾素的產生,從而啟動抗病毒反應。
C型凝集素受體(C-Type Lectin Receptors, CLRs)是一類能夠識別碳水化合物結構的PRRs。它們主要分佈在樹突細胞和巨噬細胞上,能夠識別多種病原體,尤其是真菌。例如,Dectin-1能夠識別真菌細胞壁上的β-葡聚糖,而DC-SIGN則能識別多種病原體上的高甘露糖結構。CLRs的激活不僅能夠引發直接的免疫反應,還能夠調節適應性免疫反應。
除了這些經典的PRRs,還有一些其他的分子參與病原識別。例如,補體系統中的C1q成分能夠直接識別某些病原體的表面結構,或者通過結合抗體間接識別病原體。同樣,抗菌肽不僅具有直接的殺菌作用,還能夠識別某些病原體的表面結構,並參與免疫信號的傳遞。
值得注意的是,PRRs不僅能夠識別PAMPs,還能識別DAMPs。DAMPs是機體受到損傷或細胞死亡時釋放的分子,如熱休克蛋白、尿酸晶體、ATP等。這種能力使得免疫系統不僅能夠對外來入侵做出反應,還能對組織損傷做出反應,從而在更廣泛的範圍內保護機體。
病原識別後的信號傳遞是啟動免疫反應的關鍵步驟。以TLRs為例,當它們識別到相應的PAMPs後,會招募適配器蛋白如MyD88或TRIF。這些適配器蛋白進而激活一系列的信號分子,如IRAK、TRAF6等,最終導致轉錄因子如NF-κB和IRF3的激活。這些轉錄因子進入細胞核後,會促進多種炎症介質和抗病毒蛋白的基因表達。
不同PRRs的激活可能會導致不同的下游反應。例如,某些TLRs的激活主要導致炎症反應,而RLRs的激活則主要導致干擾素的產生。然而,這些反應並非完全獨立,而是相互協調、相互增強的。例如,TLR3和RIG-I都能識別病毒的雙鏈RNA,它們的協同作用能夠產生更強的抗病毒反應。
病原識別的特異性和敏感性對於免疫系統的正常功能至關重要。過度敏感的識別可能導致自身免疫疾病,而識別不足則可能導致感染。因此,PRRs的表達和活性受到嚴格的調控。例如,某些PRRs只在特定的細胞類型或特定的細胞狀態下表達。此外,PRRs的活性還受到多種負調控機制的控制,以防止過度的免疫反應。
病原識別還與適應性免疫反應的啟動密切相關。當樹突細胞等抗原呈遞細胞的PRRs被激活時,不僅會產生炎症介質,還會上調共刺激分子的表達。這些變化使得抗原呈遞細胞能夠更有效地激活T細胞,從而啟動適應性免疫反應。
近年來的研究發現,病原識別的機制比我們之前認識的更為複雜。例如,某些PRRs可能需要與其他分子協同作用才能有效識別病原體。此外,不同PRRs之間可能存在交叉對話,共同決定最終的免疫反應類型。這種複雜性使得免疫系統能夠對不同類型的威脅做出更加精細和適當的反應。
病原識別的研究不僅有助於我們理解免疫系統的工作原理,還為開發新的治療策略提供了重要的理論基礎。例如,TLR激動劑已被用作某些疫苗的佐劑,以增強疫苗的效果。另一方面,針對PRRs的抑制劑也正在被研究用於治療某些自身免疫疾病。
此外,病原識別機制的研究還揭示了某些病原體如何逃避免疫系統的識別。例如,某些病毒能夠通過改變其核酸結構來避免被RLRs識別,而某些細菌則能夠修飾其LPS結構來減弱TLR4的激活。了解這些逃避機制不僅有助於我們理解某些持續性感染的原因,還為開發新的抗感染策略提供了思路。
值得注意的是,病原識別並非一個靜態的過程。隨著感染的進展,不同的PRRs可能被依次激活,產生動態變化的免疫反應。例如,在病毒感染的早期,可能主要是RLRs被激活,產生干擾素反應。而隨著感染的進展,可能會有更多的PAMPs被釋放出來,激活更多類型的PRRs,從而產生更全面的免疫反應。
病原識別的研究還揭示了免疫系統與其他生理系統之間的相互作用。例如,某些神經遞質受體也能夠識別某些PAMPs,這提示了神經系統和免疫系統之間可能存在直接的相互作用。同樣,某些代謝產物也能被PRRs識別,這揭示了代謝狀態可能直接影響免疫反應的強度和類型。
病原識別是免疫系統功能的基礎,它使得免疫系統能夠快速、有效地識別潛在的威脅並做出適當的反應。通過複雜的受體系統和信號網絡,病原識別機制不僅能夠啟動直接的防禦反應,還能夠協調整個免疫系統的運作,包括啟動適應性免疫反應。深入理解病原識別的機制不僅有助於我們更好地理解免疫系統的工作原理,還為開發新的診斷、預防和治療策略提供了重要的理論基礎。
自然殺手細胞(Natural Killer Cells,簡稱NK細胞)是固有免疫系統中一類獨特而重要的淋巴細胞。這些細胞因其能夠在沒有預先激活的情況下直接殺死目標細胞而得名。NK細胞在抵抗病毒感染、清除腫瘤細胞以及調節整體免疫反應中扮演著關鍵角色。
NK細胞起源於骨髓中的造血幹細胞,經過一系列分化和成熟過程後進入血液循環和各種組織。與T細胞和B細胞不同,NK細胞不需要經過胸腺教育,也不需要特異性抗原刺激就能發揮功能。這種特性使得NK細胞能夠迅速對威脅做出反應,成為機體抵抗早期感染和腫瘤的重要防線。
NK細胞的識別機制是其功能的核心。與其他免疫細胞不同,NK細胞主要通過"缺失自我"(missing-self)和"危險信號"(stress-induced self)兩種機制來識別目標細胞。"缺失自我"理論認為,NK細胞會攻擊那些表面缺乏或表達減少主要組織相容性複合體(Major Histocompatibility Complex,MHC)I類分子的細胞。正常細胞表面都有MHC I類分子,這些分子能與NK細胞上的抑制性受體結合,阻止NK細胞的殺傷作用。然而,許多病毒感染的細胞和腫瘤細胞會下調MHC I類分子的表達,從而逃避T細胞的識別。這種策略卻使它們成為NK細胞攻擊的目標。
"危險信號"機制則是指NK細胞能夠識別細胞表面表達的某些應激分子。這些分子通常在細胞受到病毒感染、DNA損傷或其他應激條件下表達增加。NK細胞上的活化受體能夠識別這些分子,從而觸發殺傷反應。例如,NKG2D是NK細胞上一個重要的活化受體,它能夠識別MICA和MICB等應激分子。
NK細胞的功能受到其表面多種抑制性和活化性受體的精密調控。抑制性受體主要包括殺傷細胞免疫球蛋白樣受體(Killer Cell Immunoglobulin-like Receptors,KIRs)和CD94/NKG2A複合物。這些受體與MHC I類分子結合後,會抑制NK細胞的活化。活化性受體則包括自然細胞毒性受體(Natural Cytotoxicity Receptors,NCRs)、NKG2D和某些KIRs亞型。這些受體識別目標細胞表面的特定配體後,會觸發NK細胞的活化。
NK細胞的殺傷機制主要有兩種:釋放細胞毒性顆粒和死亡受體介導的細胞凋亡。當NK細胞被激活後,會釋放含有穿孔素和顆粒酶的細胞毒性顆粒。穿孔素能在目標細胞膜上形成孔道,使顆粒酶進入細胞內,引發細胞凋亡。另一種機制是通過表達的Fas配體(FasL)與目標細胞表面的Fas受體結合,直接誘導目標細胞凋亡。
除了直接殺傷作用,NK細胞還能分泌多種細胞因子和趨化因子,參與調節整體免疫反應。其中最重要的是干擾素-γ(IFN-γ),它能夠激活巨噬細胞,增強抗病毒反應,並促進Th1型適應性免疫反應的發展。NK細胞還能分泌腫瘤壞死因子-α(TNF-α)、粒細胞-巨噬細胞集落刺激因子(GM-CSF)等,這些因子能夠進一步增強免疫反應,協調其他免疫細胞的功能。
NK細胞的活化還受到其他免疫細胞和細胞因子的影響。例如,樹突細胞分泌的白細胞介素-12(IL-12)和I型干擾素能夠顯著增強NK細胞的活性。反過來,NK細胞分泌的IFN-γ也能促進樹突細胞的成熟和功能。這種相互作用形成了一個正反饋循環,有助於增強整體的免疫反應。
近年來的研究發現,NK細胞具有一定的"記憶"能力,這打破了固有免疫細胞不具備免疫記憶的傳統認知。某些情況下,NK細胞在經歷特定刺激後,能夠產生長期存活的"記憶樣"NK細胞。這些細胞在再次遇到相同刺激時,能夠產生更強、更快的反應。這種特性為開發基於NK細胞的疫苗策略提供了新的可能性。
NK細胞在多種疾病的發生和發展中發揮重要作用。在病毒感染方面,NK細胞是抵抗早期病毒感染的關鍵。例如,在流感病毒感染的早期階段,NK細胞能夠通過直接殺傷感染細胞和分泌IFN-γ來控制病毒的擴散。在人類免疫缺陷病毒(HIV)感染中,NK細胞也能夠識別並殺死被感染的CD4+ T細胞,幫助控制病毒載量。
在腫瘤免疫方面,NK細胞是機體抵抗腫瘤的重要力量。許多腫瘤細胞會下調MHC I類分子的表達以逃避T細胞的識別,但這恰恰使它們成為NK細胞的攻擊目標。此外,腫瘤細胞常常表達應激相關分子,如MICA/B,這些分子能被NK細胞的活化受體識別。臨床研究發現,NK細胞數量和功能的降低與多種癌症的發生和預後不良相關。
NK細胞還參與自身免疫疾病的發生和調控。在某些自身免疫疾病中,如系統性紅斑狼瘡和類風濕關節炎,NK細胞的數量和功能都有所改變。然而,NK細胞在這些疾病中的作用是複雜的,既可能促進疾病發展,也可能起到調節作用,抑制過度的免疫反應。
在懷孕過程中,NK細胞也扮演著重要角色。子宮NK細胞(uterine NK cells)是早期妊娠過程中子宮內膜中最豐富的白細胞類型。這些細胞參與調節滋養層細胞的侵入和螺旋動脈的重塑,對胎盤的正常發育至關重要。子宮NK細胞的異常與多種妊娠併發症相關,如先兆子癇和胎兒生長受限。
NK細胞的這些特性和功能使其成為免疫治療的重要靶點。在腫瘤治療方面,已經開發出多種基於NK細胞的治療策略。例如,使用細胞因子如IL-2和IL-15來激活和擴增體內NK細胞,或者體外擴增自體NK細胞後回輸給患者。另一種策略是使用雙特異性抗體,一端與NK細胞的活化受體結合,另一端與腫瘤特異性抗原結合,從而增強NK細胞對腫瘤的識別和殺傷。
此外,一些藥物也被發現能夠增強NK細胞的功能。例如,某些蛋白酶體抑制劑不僅能直接殺傷腫瘤細胞,還能上調腫瘤細胞表面NK細胞配體的表達,增強NK細胞的殺傷作用。一些表觀遺傳調節劑也能增強NK細胞的功能,這為聯合免疫治療提供了新的思路。
然而,NK細胞療法也面臨一些挑戰。例如,如何在體內維持NK細胞的長期活性,如何增強NK細胞在實體腫瘤微環境中的滲透和存活能力,以及如何避免NK細胞療法可能帶來的副作用等,都是需要進一步研究解決的問題。
NK細胞的研究不僅局限於其在免疫系統中的作用,還涉及到與其他生理系統的相互作用。例如,研究發現NK細胞能夠影響造血幹細胞的功能,參與調節造血過程。在神經系統中,NK細胞被發現可能參與多發性硬化等神經炎症性疾病的發生和發展。這些發現進一步拓展了我們對NK細胞功能的認識,也為相關疾病的治療提供了新的思路。
隨著單細胞測序技術的發展,研究者們發現NK細胞群體的異質性比以前認為的更加複雜。不同亞群的NK細胞可能具有不同的功能特點和組織分佈特徵。這種異質性的深入研究有望為更精準的NK細胞靶向治療策略提供基礎。
免疫補體系統是固有免疫的重要組成部分,它是由一系列蛋白質組成的複雜級聯反應系統。這個系統在血清和其他體液中普遍存在,能夠協助抗體和吞噬細胞清除病原體,並在炎症反應和適應性免疫反應的調節中發揮重要作用。補體系統的發現可以追溯到19世紀末,當時科學家們發現血清中存在一種能夠"補充"抗體殺菌作用的成分,因此得名"補體"。
補體系統由超過30種蛋白質組成,這些蛋白質主要由肝臟產生,並以非活性前體的形式在血液中循環。當受到特定刺激時,這些蛋白質會按照特定順序被激活,形成一系列的酶複合物,最終導致靶細胞的裂解或吞噬。
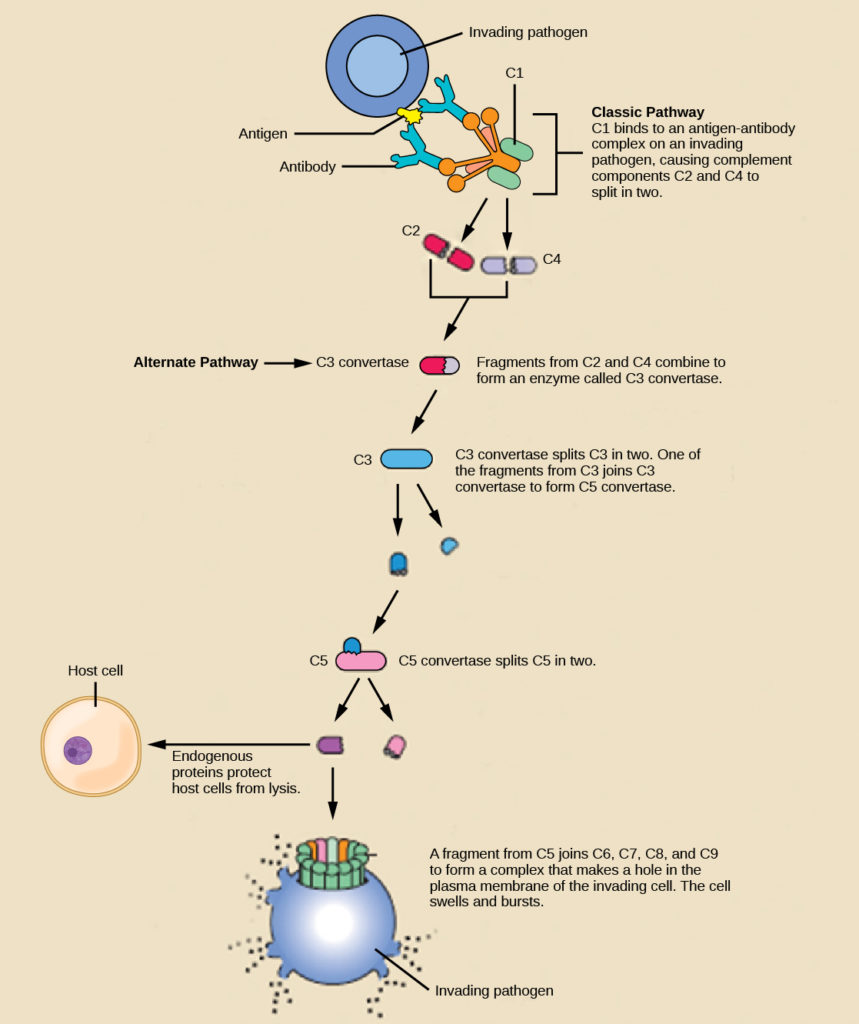
經典途徑(Classical Pathway):這是最早被發現的補體激活途徑。它主要由抗原-抗體複合物觸發,特別是IgM和某些亞類的IgG。當這些抗體與病原體結合後,會暴露出Fc區域,從而被補體成分C1q識別和結合。這種結合引發了C1複合物的構型變化,啟動了後續的級聯反應。
替代途徑(Alternative Pathway):這條途徑不需要抗體參與,可以由病原體表面的特定分子直接激活。在正常情況下,C3蛋白會緩慢地自發水解為C3(H2O)。在病原體表面,這種水解產物可以結合因子B,形成C3轉化酶,從而啟動級聯反應。健康的自身細胞表面有調節蛋白,能夠抑制這一過程,因此正常細胞不會被攻擊。
凝集素途徑(Lectin Pathway):這條途徑是最近才被發現的。它主要由甘露糖結合凝集素(Mannose-Binding Lectin, MBL)或絲氨酸蛋白酶(Ficolins)識別病原體表面的碳水化合物結構而啟動。MBL與C1q結構相似,但它識別的是糖類而非抗體。
無論通過哪條途徑被激活,補體系統最終都會形成C3轉化酶。這種酶能夠將大量的C3裂解為C3a和C3b。C3b是補體系統的核心效應分子,它能夠直接結合到病原體表面,標記其被吞噬細胞識別和清除,這個過程被稱為調理作用(Opsonization)。同時,C3b還能夠參與形成C5轉化酶,進一步激活後續的補體成分。
C5轉化酶將C5裂解為C5a和C5b。C5b隨後與C6、C7、C8和多個C9分子結合,形成膜攻擊複合物(Membrane Attack Complex, MAC)。MAC能夠在靶細胞膜上形成孔洞,導致細胞溶解。這種直接的裂解作用對於某些革蘭氏陰性細菌特別有效。
補體系統的激活不僅能夠直接殺死病原體,還能產生一系列具有重要生物學功能的小分子片段。例如,C3a和C5a是強效的炎症介質,能夠增加血管通透性,吸引和活化白細胞。C5a還能夠刺激肥大細胞釋放組胺,進一步增強炎症反應。
補體系統與適應性免疫系統有著密切的聯繫。例如,C3b和C4b能夠與B細胞表面的補體受體結合,降低B細胞活化的閾值,從而增強抗體產生。此外,補體激活產物還能夠促進抗原的保留在生發中心,有利於高親和力抗體的產生。
補體調節蛋白:這些蛋白質能夠抑制補體的激活或加速已形成的活性分子的降解。例如,CD55(衰變加速因子)能夠加速C3轉化酶的分解,而CD59則能夠阻止MAC的形成。
補體成分的短暫活性:許多活化的補體成分具有很短的半衰期,如果沒有及時與靶標結合,就會迅速失活。
補體受體:這些受體能夠介導補體標記的顆粒或免疫複合物的清除,從而限制補體激活的程度和持續時間。
補體系統在多種疾病的發生和發展中發揮重要作用。在感染性疾病中,補體系統是抵抗病原體的重要防線。例如,在細菌性腦膜炎中,補體系統的激活對於控制感染至關重要。然而,某些病原體已經進化出逃避或利用補體系統的策略。例如,某些細菌能夠分泌模擬補體調節蛋白的分子,從而避免被補體攻擊。
在自身免疫疾病中,補體系統的異常激活可能導致組織損傷。例如,在系統性紅斑狼瘡中,補體介導的組織損傷是疾病發展的重要機制之一。另一方面,某些補體缺陷也可能增加自身免疫疾病的風險。例如,C1q缺陷與系統性紅斑狼瘡的發病密切相關。
在器官移植領域,補體系統參與了排斥反應的多個階段。在超急性排斥反應中,預存的抗體可以迅速激活補體系統,導致移植器官的血管內皮細胞損傷。因此,抑制補體活性已成為預防和治療器官排斥的重要策略之一。
補體系統還參與了多種神經退行性疾病的發生和發展。例如,在阿爾茨海默病中,β-澱粉樣蛋白斑塊可以激活補體系統,導致神經炎症和神經元損傷。在多發性硬化中,補體系統的異常激活也可能加劇髓鞘和軸突的損傷。
基於對補體系統功能的深入理解,研究者們已經開發出多種針對補體系統的治療策略。例如,依庫珠單抗(Eculizumab)是一種抗C5單克隆抗體,能夠阻止MAC的形成,已被用於治療陣發性睡眠性血紅蛋白尿症和非典型溶血尿毒綜合征。另一種補體抑制劑C1抑制劑(C1-INH)則被用於治療遺傳性血管性水腫。
然而,補體靶向治療也面臨一些挑戰。全身性抑制補體系統可能增加感染風險,特別是對莢膜細菌的易感性。因此,開發更精準的、局部作用的補體調節策略成為當前研究的重點之一。
此外,補體系統的功能還遠未被完全理解。近年來的研究發現,補體系統不僅參與免疫防禦,還可能在胚胎發育、組織再生、脂質代謝等過程中發揮作用。例如,某些補體成分被發現可以促進肝臟再生和骨骼肌修復。這些發現進一步拓展了我們對補體系統功能的認識,也為相關疾病的治療提供了新的思路。
隨著基因組學和蛋白質組學技術的發展,研究者們正在深入探索補體系統的遺傳變異如何影響個體對疾病的易感性和藥物反應。這些研究有望為個體化的補體靶向治療策略提供依據。
補體系統的研究還涉及到與其他免疫成分的相互作用。例如,補體系統與凝血系統、纖溶系統之間存在複雜的交叉對話。這種相互作用在某些疾病狀態下尤為重要,如敗血症和彌散性血管內凝血。深入理解這些系統間的相互作用,有助於開發更全面、更有效的治療策略。
適應性免疫反應是人體免疫系統中一個高度特異性和複雜的防禦機制,它能夠識別並記憶特定的病原體,從而在再次遇到同樣的病原體時做出更快速、更有效的反應。與固有免疫不同,適應性免疫反應需要時間來發展,但能夠提供更精確的防禦。
適應性免疫反應的核心參與者是T細胞和B細胞,這兩種細胞都屬於淋巴細胞家族。T細胞和B細胞都起源於骨髓中的造血幹細胞,但它們的成熟過程和功能有所不同。B細胞在骨髓中完成成熟,而T細胞則需要遷移到胸腺中進行進一步的發育和選擇。
T細胞主要負責細胞介導的免疫反應。它們可以進一步分為幾個亞型,包括輔助T細胞(CD4+ T細胞)和細胞毒性T細胞(CD8+ T細胞)。輔助T細胞通過分泌細胞因子來調節其他免疫細胞的功能,而細胞毒性T細胞則能夠直接殺死被感染的細胞或腫瘤細胞。
B細胞則主要負責體液免疫反應。當B細胞被激活後,它們會分化為漿細胞,產生大量的抗體。這些抗體能夠特異性地結合病原體或其產物,從而中和它們的毒性,或者標記它們以便其他免疫細胞進行清除。
適應性免疫反應的一個關鍵特徵是抗原特異性。每個T細胞或B細胞都擁有獨特的受體,這些受體能夠識別特定的抗原。這種特異性是通過基因重排(gene rearrangement)過程產生的,這個過程能夠產生數以億計的不同受體組合,從而使免疫系統能夠識別幾乎任何可能遇到的病原體。
T細胞受體(TCR)和B細胞受體(BCR,實際上是細胞膜結合形式的抗體)的多樣性是通過V(D)J重組實現的。在這個過程中,編碼受體可變區的基因片段被隨機組合,再加上接頭區的不精確連接,產生了巨大的受體多樣性。這種多樣性使得適應性免疫系統能夠應對各種未知的病原體。
適應性免疫反應的另一個重要特徵是免疫記憶。當免疫系統首次遇到一種新的病原體時,需要一段時間來產生特異性的反應,這被稱為初次免疫反應。在這個過程中,一部分被激活的T細胞和B細胞會分化為記憶細胞。這些記憶細胞能夠長期存活,並在再次遇到同樣的病原體時迅速被激活,產生更快速、更強烈的次級免疫反應。這就是疫苗接種原理的基礎。
適應性免疫反應的啟動需要幾個關鍵步驟。首先,抗原需要被呈遞給T細胞。這個過程主要由專業的抗原呈遞細胞(APCs)完成,如樹突細胞、巨噬細胞和B細胞。這些細胞能夠攝取、處理抗原,並將抗原肽與主要組織相容性複合體(MHC)分子結合,呈遞在細胞表面。
CD4+ T細胞通過其TCR識別MHC II類分子呈遞的抗原肽,而CD8+ T細胞則識別MHC I類分子呈遞的抗原肽。這種MHC限制確保了T細胞只能識別由自身細胞呈遞的抗原,這是防止自身免疫反應的重要機制之一。
T細胞的完全活化還需要第二信號,即共刺激信號。這通常由APC表面的共刺激分子(如CD80/CD86)與T細胞表面的CD28相互作用提供。缺乏共刺激信號可能導致T細胞無能(anergy)或凋亡,這是另一個防止自身免疫反應的機制。
一旦T細胞被完全激活,它們會開始增殖並分化為效應T細胞。CD4+ T細胞可以進一步分化為不同的亞型,如Th1、Th2、Th17和調節性T細胞(Tregs),每種亞型都有特定的功能和分泌特定的細胞因子。例如,Th1細胞主要產生干擾素-γ(IFN-γ),促進細胞介導的免疫反應;Th2細胞則產生白細胞介素-4(IL-4)和IL-5,促進體液免疫反應。
B細胞的活化通常需要T細胞的幫助。當B細胞通過其BCR識別並內化抗原後,它會將處理後的抗原肽通過MHC II類分子呈遞給CD4+ T細胞。被激活的T細胞則通過CD40L-CD40相互作用和分泌細胞因子來幫助B細胞活化。這種T細胞依賴性的B細胞活化通常發生在次級淋巴器官的生發中心。
在生發中心,B細胞經歷體細胞高頻突變和親和力成熟過程。體細胞高頻突變會引入BCR基因的隨機突變,而親和力成熟則通過選擇那些與抗原結合更緊密的B細胞克隆來提高抗體的親和力。這個過程確保了產生的抗體能夠更有效地識別和中和病原體。
被完全激活的B細胞最終會分化為漿細胞或記憶B細胞。漿細胞能夠產生大量的抗體,這些抗體被釋放到血液和其他體液中,發揮保護作用。記憶B細胞則長期存活,為未來可能的再次感染做好準備。
適應性免疫反應的調節是一個複雜的過程,涉及多種機制。例如,調節性T細胞(Tregs)能夠抑制其他T細胞的活性,防止過度的免疫反應。另外,抑制性受體如CTLA-4和PD-1也能夠限制T細胞的活化。這些調節機制對於維持免疫耐受和防止自身免疫疾病至關重要。
適應性免疫系統還具有區分自身和非自身的能力。這種能力主要通過中央耐受和外周耐受兩種機制實現。中央耐受發生在T細胞和B細胞的發育過程中,通過清除或使那些強烈識別自身抗原的細胞失能來實現。外周耐受則通過多種機制在成熟淋巴細胞中維持,包括抑制性細胞和分子的作用、克隆清除和克隆無能等。
適應性免疫反應在多種疾病的發生、發展和治療中起著關鍵作用。在感染性疾病中,適應性免疫反應能夠特異性地識別和清除病原體,並形成長期的免疫記憶。這是疫苗預防感染性疾病的基礎。然而,某些病原體已經進化出逃避適應性免疫反應的策略,如抗原漂移和抗原變異,這給疫苗開發帶來了挑戰。
在腫瘤免疫中,適應性免疫系統扮演著雙重角色。一方面,T細胞和B細胞能夠識別腫瘤特異性抗原或腫瘤相關抗原,發起抗腫瘤免疫反應。另一方面,腫瘤細胞可能通過多種機制逃避或抑制這種免疫監視。基於對這些機制的理解,研究者們開發出了多種腫瘤免疫療法,如免疫檢查點抑制劑和CAR-T細胞療法。
在自身免疫疾病中,適應性免疫系統對自身抗原產生了錯誤的反應。這可能是由於中央或外周耐受機制的失效,或者環境因素觸發了對自身抗原的反應。理解這些疾病的發病機制有助於開發更精準的治療策略,如靶向特定T細胞亞群或B細胞的療法。
適應性免疫反應還在器官移植中起著重要作用。受體的T細胞和B細胞能夠識別供體組織上的異體抗原,引發排斥反應。為了防止排斥,需要使用免疫抑制劑來抑制這種反應。然而,過度的免疫抑制可能增加感染和腫瘤的風險。因此,如何在抑制排斥反應和維持足夠的免疫功能之間取得平衡是器官移植領域的一個重要挑戰。
適應性免疫反應的研究還涉及到與其他生理系統的相互作用。例如,神經系統和內分泌系統都能影響適應性免疫反應的強度和類型。應激、睡眠質量等因素也可能通過這些系統間的相互作用影響適應性免疫功能。這種複雜的相互關係解釋了為什麼生活方式和心理狀態會影響一個人的免疫力。
隨著技術的進步,我們對適應性免疫反應的理解正在不斷深化。例如,單細胞測序技術揭示了T細胞和B細胞群體的高度異質性,這為更精準的免疫干預策略提供了基礎。此外,系統生物學方法正在幫助我們理解適應性免疫反應中的複雜調控網絡,這可能lead to新的治療靶點的發現。
抗原呈遞細胞(Antigen-Presenting Cells, APCs)是適應性免疫反應中的關鍵參與者,它們在連接固有免疫和適應性免疫反應中扮演著重要角色。這些細胞的主要功能是捕獲、處理和呈遞抗原給T細胞,從而啟動特異性的免疫反應。最常見的專業抗原呈遞細胞包括樹突細胞、巨噬細胞和B細胞,其中樹突細胞被認為是最有效的抗原呈遞細胞。
樹突細胞是一類高度專業化的抗原呈遞細胞,它們分佈在全身各處,尤其是在與外界環境接觸的組織中,如皮膚和黏膜。樹突細胞有多個亞型,包括骨髓源性樹突細胞和漿細胞樣樹突細胞。這些細胞具有獨特的樹枝狀突起,這種形態增加了它們與周圍環境接觸的表面積,有利於抗原的捕獲。
樹突細胞的生命週期可以分為兩個主要階段:未成熟階段和成熟階段。未成熟的樹突細胞主要分佈在外周組織,它們具有強大的抗原捕獲能力,但表達較少的主要組織相容性複合體(Major Histocompatibility Complex, MHC)分子和共刺激分子。這些細胞通過多種機制捕獲抗原,包括吞噬作用、巨胞飲作用和受體介導的內吞作用。
當樹突細胞捕獲到病原體或感受到炎症信號(如病原體相關分子模式,PAMPs)時,它們會啟動成熟過程。成熟過程中,樹突細胞會上調MHC分子和共刺激分子(如CD80/CD86)的表達,同時減少抗原捕獲能力,並獲得向淋巴結遷移的能力。這種遷移是通過趨化因子受體CCR7的表達實現的,CCR7能夠識別淋巴組織中的趨化因子CCL19和CCL21。
在淋巴結中,成熟的樹突細胞會呈遞處理後的抗原給T細胞。抗原呈遞過程涉及兩類主要的MHC分子:MHC I類分子和MHC II類分子。MHC I類分子主要呈遞來自細胞內的抗原(如病毒蛋白),而MHC II類分子則主要呈遞來自細胞外或內吞小體中的抗原。
樹突細胞還具有交叉呈遞(cross-presentation)的能力,即它們能夠將外源性抗原通過MHC I類分子呈遞給CD8+ T細胞。這種能力對於啟動針對某些病毒和腫瘤的細胞毒性T細胞反應非常重要。
巨噬細胞是另一類重要的抗原呈遞細胞。它們廣泛分佈於全身各個組織中,是組織中最豐富的吞噬細胞。巨噬細胞不僅能夠吞噬和清除病原體,還能處理和呈遞抗原。與樹突細胞相比,巨噬細胞的抗原呈遞能力相對較弱,但它們在某些特定情況下仍然發揮著重要作用,特別是在慢性炎症和某些自身免疫疾病中。
巨噬細胞的活化狀態會影響其抗原呈遞能力。經典活化的M1型巨噬細胞通常具有較強的抗原呈遞能力,它們表達高水準的MHC II類分子和共刺激分子。相比之下,替代活化的M2型巨噬細胞的抗原呈遞能力較弱,它們更多地參與組織修復和抗炎症反應。
B細胞是第三類主要的抗原呈遞細胞。與樹突細胞和巨噬細胞不同,B細胞主要通過其B細胞受體(BCR)特異性地捕獲抗原。這種特異性捕獲使得B細胞能夠高效地呈遞低濃度的特定抗原。被BCR捕獲的抗原會被內化、處理,然後通過MHC II類分子呈遞給CD4+ T細胞。這個過程不僅啟動了T細胞反應,還是B細胞自身獲得T細胞幫助的關鍵步驟。
除了這三類主要的專業抗原呈遞細胞外,在某些特定情況下,其他類型的細胞也能夠呈遞抗原。例如,在某些炎症條件下,上皮細胞和內皮細胞可以上調MHC II類分子的表達,從而獲得抗原呈遞能力。此外,在中樞神經系統中,小膠質細胞可以作為主要的抗原呈遞細胞。
抗原呈遞細胞的功能不僅限於抗原的捕獲和呈遞。它們還通過分泌細胞因子來塑造免疫反應的類型。例如,樹突細胞分泌的IL-12可以促進Th1型反應,而分泌IL-4則可以促進Th2型反應。這種能力使得抗原呈遞細胞成為調節適應性免疫反應方向的關鍵因素。
抗原呈遞細胞還參與免疫耐受的維持。例如,某些亞型的樹突細胞,如漿細胞樣樹突細胞和調節性樹突細胞,能夠促進調節性T細胞(Tregs)的產生,從而抑制過度的免疫反應。在穩態條件下,未成熟的樹突細胞呈遞自身抗原時,由於缺乏適當的共刺激信號,可能導致T細胞無能或凋亡,這是維持外周耐受的重要機制之一。
抗原呈遞細胞在多種疾病的發生、發展和治療中發揮著重要作用。在感染性疾病中,這些細胞是啟動針對病原體的特異性免疫反應的關鍵。然而,某些病原體已經進化出逃避或抑制抗原呈遞細胞功能的策略。例如,HIV病毒可以感染樹突細胞,並利用這些細胞作為傳播的載體。
在腫瘤免疫中,抗原呈遞細胞的功能常常受到抑制。腫瘤微環境中的各種因素,如TGF-β和IL-10,可以抑制樹突細胞的成熟和功能。因此,如何增強腫瘤微環境中抗原呈遞細胞的功能成為腫瘤免疫治療的一個重要策略。例如,某些腫瘤疫苗就是通過激活和增強樹突細胞的功能來增強抗腫瘤免疫反應。
在自身免疫疾病中,抗原呈遞細胞可能異常地呈遞自身抗原,導致自身反應性T細胞的活化。例如,在系統性紅斑狼瘡中,漿細胞樣樹突細胞可能通過呈遞來自凋亡細胞的核抗原來促進疾病的發展。因此,調節抗原呈遞細胞的功能成為治療自身免疫疾病的一個潛在策略。
在器官移植中,供體來源的抗原呈遞細胞可以通過直接和間接途徑激活受體的T細胞,引發排斥反應。直接途徑是指受體T細胞直接識別供體抗原呈遞細胞表面的MHC-抗原複合物,而間接途徑則是受體的抗原呈遞細胞處理和呈遞供體抗原。理解這些過程有助於開發更有效的預防排斥反應的策略。
抗原呈遞細胞的研究為開發新的疫苗和免疫治療策略提供了重要基礎。例如,靶向樹突細胞的疫苗已經在臨床上顯示出promising的效果。這些疫苗通過將抗原直接遞送到樹突細胞,或者通過特定的佐劑來激活樹突細胞,從而增強疫苗的免疫原性。
另一個重要的研究方向是利用體外培養的抗原呈遞細胞進行治療。例如,樹突細胞疫苗是一種個體化的癌症免疫療法,它涉及從患者體內分離單核細胞,在體外將其分化為樹突細胞,然後用腫瘤抗原刺激這些細胞,最後將其回輸給患者。這種方法旨在增強患者體內的抗腫瘤免疫反應。
隨著單細胞技術的發展,我們對抗原呈遞細胞的異質性有了更深入的理解。研究發現,即使是同一類型的抗原呈遞細胞,也可能存在多個功能不同的亞群。這種異質性可能反映了抗原呈遞細胞適應不同組織微環境和免疫挑戰的能力。深入理解這種異質性有望lead to更精準的免疫干預策略。
抗原呈遞細胞與其他免疫細胞之間的相互作用也是當前研究的熱點。例如,最近的研究發現,NK細胞可以影響樹突細胞的成熟和功能,而樹突細胞也可以通過分泌細胞因子來調節NK細胞的活性。這種複雜的細胞間對話網絡對於協調整體免疫反應至關重要。
抗原呈遞細胞是連接固有免疫和適應性免疫的橋樑,在啟動和調節免疫反應中發揮著關鍵作用。深入理解這些細胞的功能和調控機制,不僅有助於我們更好地理解免疫系統的工作原理,還為開發新的免疫干預策略提供了重要的理論基礎。隨著研究的深入,我們有望開發出更精準、更有效的免疫治療方法,為多種疾病的預防和治療帶來新的希望。
T細胞和B細胞是適應性免疫系統的核心組成部分,它們共同負責識別特定抗原並對其做出反應。這兩種細胞類型雖然都源自骨髓中的造血幹細胞,但它們的發育路徑、功能和作用機制有顯著的不同。
T細胞的發育主要在胸腺中進行,這也是它們名稱的由來(Thymus-derived cells)。早期的T細胞前體從骨髓遷移到胸腺後,經歷一系列複雜的發育階段。在這個過程中,T細胞通過基因重排形成獨特的T細胞受體(T Cell Receptor, TCR)。TCR的多樣性是通過V(D)J重組實現的,這個過程能夠產生大量不同的TCR組合,使T細胞能夠識別各種不同的抗原。
在胸腺中,T細胞還要經過正選擇和負選擇過程。正選擇確保T細胞能夠識別自身MHC分子,而負選擇則清除那些強烈識別自身抗原的T細胞。這個過程是建立中央免疫耐受的關鍵機制,有助於防止自身免疫疾病的發生。
成熟的T細胞主要分為兩大類:輔助T細胞(CD4+ T細胞)和細胞毒性T細胞(CD8+ T細胞)。CD4+ T細胞主要通過分泌細胞因子來協調免疫反應,而CD8+ T細胞則能夠直接殺死被感染的細胞或腫瘤細胞。
CD4+ T細胞可以進一步分化為多個亞型,包括Th1、Th2、Th17和調節性T細胞(Tregs)等。每種亞型都有特定的功能和分泌特定的細胞因子。例如,Th1細胞主要產生干擾素-γ(IFN-γ),促進細胞介導的免疫反應,特別是對抗細胞內病原體;Th2細胞則產生白細胞介素-4(IL-4)和IL-5,促進體液免疫反應,對抗細胞外病原體;Th17細胞產生IL-17,參與抵抗細菌和真菌感染;Tregs則通過產生轉化生長因子-β(TGF-β)和IL-10來抑制免疫反應,維持免疫耐受。
CD8+ T細胞在被激活後,能夠分泌穿孔素和顆粒酶,這些物質能夠穿透目標細胞的細胞膜,導致細胞凋亡。此外,活化的CD8+ T細胞還能分泌IFN-γ和腫瘤壞死因子-α(TNF-α),這些細胞因子能夠增強抗病毒反應並抑制腫瘤生長。
B細胞的發育主要在骨髓中進行,成熟後遷移到外周淋巴組織。B細胞的主要功能是產生抗體,但它們也能作為抗原呈遞細胞。B細胞通過其B細胞受體(BCR)識別抗原,BCR實際上是細胞膜結合形式的抗體。
B細胞的發育過程也涉及基因重排,形成多樣化的BCR。在骨髓中,B細胞要經過中央耐受機制的篩選,清除那些對自身抗原有強烈反應的細胞。成熟的B細胞離開骨髓後,主要分佈在淋巴結、脾臟等次級淋巴器官中。
當B細胞遇到其特異性抗原並得到T細胞的幫助後,會被活化並開始增殖。一部分活化的B細胞會分化為漿細胞,產生大量的抗體;另一部分則形成記憶B細胞,為未來可能的再次感染做準備。
在生發中心反應中,B細胞還會經歷體細胞高頻突變和類別轉換。體細胞高頻突變能夠進一步增加抗體的多樣性,而類別轉換則使B細胞能夠產生不同類型的抗體(如IgG、IgA、IgE等),這些抗體在不同的組織和環境中發揮不同的功能。
T細胞和B細胞之間存在複雜的相互作用。大多數B細胞反應需要T細胞的幫助,這種幫助主要通過CD40-CD40L相互作用和細胞因子提供。反過來,B細胞也能作為抗原呈遞細胞激活T細胞。這種相互作用確保了體液免疫和細胞介導的免疫反應的協調。
T細胞和B細胞在多種疾病的發生、發展和治療中發揮重要作用。在感染性疾病中,這些細胞協同工作以清除病原體並建立長期免疫。例如,在病毒感染中,CD8+ T細胞能夠直接殺死被感染的細胞,而B細胞產生的抗體則能中和遊離的病毒顆粒。
在自身免疫疾病中,T細胞和B細胞的失調可能導致對自身組織的攻擊。例如,在類風濕關節炎中,自身反應性的T細胞和B細胞共同參與了對關節組織的破壞。因此,針對T細胞和B細胞的治療策略,如抗CD20抗體(靶向B細胞)和CTLA-4-Ig融合蛋白(阻斷T細胞共刺激信號),已成為治療某些自身免疫疾病的有效方法。
在腫瘤免疫中,T細胞特別是CD8+ T細胞是抗腫瘤免疫反應的主要效應細胞。然而,腫瘤常常通過多種機制抑制T細胞的功能,如上調PD-L1的表達。基於這一認識,研究者開發了免疫檢查點抑制劑,如抗PD-1/PD-L1抗體,這些藥物能夠解除T細胞的抑制狀態,增強抗腫瘤免疫反應。
B細胞在腫瘤免疫中的作用較為複雜。一方面,B細胞產生的抗體可以識別腫瘤抗原,促進抗體依賴性細胞介導的細胞毒性(ADCC);另一方面,某些調節性B細胞可能通過產生IL-10等抑制性細胞因子來抑制抗腫瘤免疫反應。
在器官移植領域,T細胞和B細胞都參與排斥反應。T細胞可以直接識別異體MHC分子,或者識別由受體抗原呈遞細胞呈遞的供體抗原肽。B細胞則可以產生針對供體抗原的抗體,這些抗體可能導致急性或慢性排斥反應。因此,目前的免疫抑制療法主要針對T細胞和B細胞的功能。
近年來,基於T細胞和B細胞的細胞療法取得了重要進展。例如,嵌合抗原受體T細胞(CAR-T)療法利用基因工程技術,使T細胞表達特定的抗原受體,從而增強其對腫瘤細胞的識別和殺傷能力。這種療法在某些血液系統惡性腫瘤的治療中已經顯示出顯著的效果。
另一方面,利用B細胞產生單克隆抗體的能力,研究者開發出了大量的治療性抗體。這些抗體可以靶向特定的分子或細胞,用於治療各種疾病,包括癌症、自身免疫疾病和某些感染性疾病。
T細胞和B細胞的研究還涉及到記憶形成的機制。免疫記憶是疫苗有效性的基礎,也是機體能夠快速應對再次感染的關鍵。研究發現,記憶T細胞和記憶B細胞可以長期存在於體內,它們能夠在再次遇到相同抗原時快速活化和擴增。深入理解這一過程有助於開發更有效的疫苗策略。
此外,T細胞和B細胞的耗竭(exhaustion)現象也是當前研究的熱點。在慢性感染和腫瘤中,持續的抗原刺激可能導致這些細胞進入功能受損的耗竭狀態。理解細胞耗竭的機制及其逆轉策略,對於提高慢性病毒感染和腫瘤的治療效果具有重要意義。
隨著單細胞技術的發展,我們對T細胞和B細胞亞群的認識也在不斷深化。研究發現,這些細胞群體的異質性比以前認為的更加複雜。例如,除了傳統的Th1、Th2等亞型外,還發現了具有可塑性的T細胞亞群,它們能夠根據微環境信號調整其功能特徵。這種異質性和可塑性的深入研究,有望為更精準的免疫干預策略提供新的靶點。
T細胞和B細胞與其他免疫細胞以及非免疫細胞之間的相互作用也是當前研究的重點。例如,T細胞與內皮細胞的相互作用在炎症過程中起重要作用,而B細胞與基質細胞的相互作用則對維持免疫記憶至關重要。理解這些複雜的細胞間相互作用,有助於我們更全面地認識免疫系統的工作原理。
黏膜表面是人體與外界環境直接接觸的重要界面,包括呼吸道、消化道和泌尿生殖道等。這些表面不僅要防禦潛在的病原體入侵,還要維持與共生微生物的和諧關係,同時對食物抗原保持耐受。黏膜免疫系統的獨特之處在於它必須在保護性免疫反應和免疫耐受之間保持精妙的平衡。
黏膜表面的免疫防禦首先依賴於物理和化學屏障。上皮細胞緊密連接,形成了一道物理屏障。這些細胞還分泌黏液,捕獲並清除微生物和其他顆粒物。黏液中含有多種抗菌物質,如溶菌酶、防禦素和分泌型免疫球蛋白A (sIgA)等。sIgA是黏膜免疫的重要組成部分,它能中和病原體,防止其附著於上皮細胞。
黏膜相關淋巴組織(Mucosa-Associated Lymphoid Tissue, MALT)是黏膜免疫系統的核心。它包括了多個部分,如腸道相關淋巴組織(Gut-Associated Lymphoid Tissue, GALT)、支氣管相關淋巴組織(Bronchus-Associated Lymphoid Tissue, BALT)等。這些組織中含有大量的T細胞、B細胞和抗原呈遞細胞,能夠快速對入侵的病原體做出反應。
在腸道中,派爾氏斑(Peyer's Patches)是GALT的重要組成部分。它們位於小腸黏膜下,由濾泡和濾泡間區域組成。濾泡主要含有B細胞,而濾泡間區域則富含T細胞。派爾氏斑上覆蓋著特化的上皮細胞,稱為M細胞(Microfold Cells)。M細胞能夠將腸腔中的抗原轉運到下方的免疫細胞,啟動免疫反應。
黏膜免疫系統中還存在一些特殊的細胞群。例如,固有淋巴樣細胞(Innate Lymphoid Cells, ILCs)在黏膜免疫中扮演重要角色。ILCs包括多個亞型,如ILC1、ILC2和ILC3。它們能夠快速響應環境信號,分泌多種細胞因子,參與炎症反應、組織修復和維持黏膜屏障完整性。
另一個重要的細胞群是γδ T細胞。這些細胞豐富存在於黏膜組織中,能夠識別非常規抗原,如應激相關分子。γδ T細胞在維持黏膜屏障完整性、抵抗病原體入侵和調節炎症反應中發揮重要作用。
黏膜免疫系統的一個關鍵特徵是其獨特的抗體反應。與系統性免疫不同,黏膜免疫以IgA為主要抗體類型。大部分的IgA以二聚體形式存在,通過上皮細胞表面的多聚免疫球蛋白受體(polymeric immunoglobulin receptor, pIgR)轉運到黏膜表面,成為分泌型IgA。這種抗體能夠有效中和病原體,而不引發強烈的炎症反應。
免疫耐受是黏膜免疫系統的另一個重要特徵。考慮到黏膜表面持續暴露於大量的外來抗原(如食物抗原和共生微生物),維持適當的免疫耐受至關重要。過度的免疫反應可能導致慢性炎症或自身免疫疾病。
口腔耐受(Oral Tolerance)是一個經典的免疫耐受例子。當通過口服途徑接觸到抗原時,機體傾向於對這些抗原產生免疫耐受,而不是激烈的免疫反應。這種機制對於防止對食物抗原產生不當的免疫反應至關重要。口腔耐受的建立涉及多種機制,包括調節性T細胞(Tregs)的誘導、克隆清除和克隆無能等。
樹突細胞在黏膜免疫耐受中扮演關鍵角色。腸道中存在多種亞型的樹突細胞,它們能夠根據接收到的信號決定是啟動免疫反應還是誘導耐受。例如,在穩態條件下,某些腸道樹突細胞亞群傾向於誘導Tregs的產生,促進免疫耐受。
腸道微生物群在維持黏膜免疫平衡中起著至關重要的作用。這些共生微生物不僅參與營養物質的代謝,還能夠塑造宿主的免疫系統。例如,某些腸道細菌能夠促進Tregs的分化,有助於維持腸道免疫耐受。另一方面,某些細菌代謝產物(如短鏈脂肪酸)能夠直接調節免疫細胞的功能,促進抗炎反應。
黏膜免疫系統的失調可能導致多種疾病。例如,在炎症性腸病(Inflammatory Bowel Disease, IBD)中,腸道黏膜免疫系統對腸道菌群產生了不當的免疫反應,導致慢性炎症。在食物過敏中,口腔耐受機制的失效導致對特定食物抗原產生過度的免疫反應。
呼吸道黏膜的免疫耐受同樣重要。肺部每天接觸大量的空氣中顆粒物,如果對這些無害的顆粒產生強烈的免疫反應,可能導致慢性炎症。然而,當遇到真正的病原體時,呼吸道黏膜免疫系統又需要迅速做出保護性反應。這種平衡的失調可能導致哮喘、慢性阻塞性肺病等疾病。
黏膜免疫系統的研究為開發新的疫苗和治療策略提供了重要基礎。例如,黏膜疫苗(如口服或鼻腔噴霧疫苗)旨在通過刺激局部黏膜免疫反應來提供保護。這種方法不僅可能提供更好的局部保護,還可能更容易施用,特別是在大規模免疫程序中。
另一個研究方向是利用黏膜免疫耐受機制來治療自身免疫疾病。例如,研究者正在探索通過口服自身抗原來誘導免疫耐受,以治療類風濕關節炎等疾病。這種方法的優勢在於它可能induces長期的免疫耐受,而不需要持續的藥物治療。
黏膜免疫系統與神經系統和內分泌系統之間的相互作用也是當前研究的熱點。例如,腸-腦軸(Gut-Brain Axis)的概念強調了腸道微生物群、黏膜免疫系統和中樞神經系統之間的雙向通信。這種相互作用可能影響多種生理和病理過程,從情緒調節到神經退行性疾病。
在腫瘤免疫學領域,黏膜相關的淋巴組織也受到關注。例如,某些腸道腫瘤可能利用腸道的免疫耐受機制來逃避免疫監視。理解這些機制可能lead to新的腫瘤免疫治療策略的開發。
黏膜免疫系統的研究還涉及到與環境因素的相互作用。例如,空氣污染可能影響呼吸道黏膜的免疫功能,而飲食習慣則可能影響腸道黏膜免疫。這些研究不僅有助於理解疾病的發生機制,還為預防策略的制定提供了依據。
黏膜免疫系統的可塑性是另一個引人注目的特點。與系統性免疫相比,黏膜免疫系統似乎更容易受到環境因素的影響。例如,飲食改變可以在相對短的時間內顯著影響腸道黏膜免疫的組成和功能。這種可塑性為通過調節生活方式來改善免疫功能提供了可能性。
在感染性疾病研究中,黏膜免疫系統也扮演著重要角色。許多病原體,如流感病毒、艾滋病病毒等,都是通過黏膜表面進入人體的。理解這些病原體如何與黏膜免疫系統相互作用,可能lead to新的預防和治療策略的開發。例如,研究者正在探索如何增強黏膜表面的先天性防禦機制,以提供更廣譜的保護。
黏膜免疫系統的研究還涉及到表觀遺傳學的影響。研究發現,環境因素可能通過表觀遺傳修飾來影響黏膜免疫細胞的功能。這些修飾可能影響基因的表達模式,從而改變細胞的功能特性。理解這些機制可能為開發新的治療方法提供思路,例如通過靶向特定的表觀遺傳修飾來調節免疫反應。
黏膜表面和免疫耐受的研究涉及多個學科領域,包括免疫學、微生物學、神經科學和營養學等。這個領域的進展不僅深化了我們對基礎生物學過程的理解,還為多種疾病的預防和治療提供了新的思路。隨著研究的深入,我們有望開發出更精準、更有效的干預策略,以維護黏膜免疫的平衡,預防和治療相關疾病。
免疫記憶是適應性免疫系統的一個核心特徵,它使得機體在再次遇到相同病原體時能夠做出更快速、更有效的免疫反應。這種能力不僅是疫苗有效性的基礎,也是我們能夠終生抵抗某些疾病的關鍵。免疫記憶主要由記憶T細胞和記憶B細胞維持,這些細胞能夠在初次免疫反應後長期存活在體內。
記憶T細胞可以分為中央記憶T細胞(TCM)和效應記憶T細胞(TEM)。TCM主要分佈在淋巴組織中,具有很強的增殖能力,但效應功能相對較弱。當再次遇到抗原時,TCM能夠迅速增殖並分化為效應T細胞。TEM則主要分佈在外周組織,特別是黏膜表面等易受感染的部位。TEM具有很強的效應功能,能夠快速產生細胞因子或發揮細胞毒性作用。
記憶B細胞同樣在免疫記憶中發揮重要作用。這些細胞通常在生發中心反應後形成,它們表達高親和力的B細胞受體(BCR),能夠快速識別特定抗原。記憶B細胞分佈在脾臟、骨髓和淋巴結等組織中,當再次遇到抗原時,它們能夠迅速活化、增殖並分化為抗體分泌細胞。
免疫記憶的形成過程是複雜的,涉及多個階段。在初次免疫反應中,一小部分效應T細胞和B細胞會分化為記憶細胞。這個過程受到多種因素的調控,包括抗原的性質、共刺激信號的強度、細胞因子環境等。例如,某些研究表明,IL-7和IL-15等細胞因子對於記憶T細胞的形成和維持至關重要。
記憶細胞的長期存活是維持免疫記憶的關鍵。與效應細胞不同,記憶細胞具有較長的壽命,這部分歸因於它們特殊的代謝特性。例如,記憶T細胞主要依賴脂肪酸氧化來獲取能量,這使得它們能夠在缺乏抗原刺激的情況下長期存活。此外,某些趨化因子受體(如CCR7)的表達使得記憶細胞能夠定位到特定的組織微環境中,獲得生存所需的信號。
免疫記憶的維持不僅依賴於記憶細胞的存活,還涉及這些細胞的持續更新。研究發現,即使在沒有抗原刺激的情況下,記憶T細胞和B細胞也會緩慢地進行自我更新。這種基礎性增殖有助於維持記憶細胞庫的穩定性。
另一個有趣的現象是異源性記憶(Heterologous Memory)。這指的是某些記憶T細胞能夠對與原始抗原不同但結構相似的抗原產生交叉反應。這種機制可能為機體提供了更廣泛的保護,但同時也可能導致某些自身免疫反應。
免疫記憶的強度和持久性受多種因素影響。例如,初次感染或疫苗接種的劑量、頻率和途徑都可能影響記憶的形成。此外,某些佐劑(如鋁鹽)的使用可以增強疫苗的免疫原性,促進更強的記憶反應。病原體的性質也很重要,一般活病原體(如減毒活疫苗)比死病原體更容易誘導強烈的免疫記憶。
免疫記憶在不同的組織和器官中可能有不同的特徵。例如,皮膚和黏膜等組織中存在所謂的組織常駐記憶T細胞(TRM)。這些細胞長期駐留在特定的組織中,能夠提供快速的局部保護。TRM的發現改變了我們對免疫記憶的理解,強調了局部免疫反應的重要性。
在某些情況下,免疫記憶可能會減弱或消失。例如,隨著年齡增長,免疫系統的功能會逐漸下降,包括記憶反應的能力。這部分解釋了為什麼老年人可能需要額外的疫苗加強。某些慢性感染,如HIV感染,也可能導致免疫記憶的損害。理解這些機制對於開發更有效的疫苗策略至關重要。
免疫記憶在多種疾病的預防和治療中發揮重要作用。在感染性疾病領域,疫苗的成功在很大程度上依賴於誘導有效的免疫記憶。例如,麻疹疫苗能夠誘導長期的保護性免疫,這主要歸功於強大的記憶T細胞和B細胞反應。然而,對於某些病原體,如流感病毒,由於病毒的快速變異,維持有效的免疫記憶變得更加困難,這也是為什麼需要每年接種流感疫苗。
在腫瘤免疫學領域,研究者正在探索如何利用免疫記憶來增強抗腫瘤反應。例如,某些癌症疫苗策略旨在誘導針對腫瘤抗原的記憶T細胞,希望這些細胞能夠在腫瘤復發時快速做出反應。此外,理解免疫記憶的機制也有助於改善細胞療法的效果,如使CAR-T細胞具有記憶特性,以提供更持久的抗腫瘤效果。
在自身免疫疾病中,不當的免疫記憶可能導致持續的組織損傷。例如,在類風濕關節炎中,針對自身抗原的記憶T細胞和B細胞可能持續存在,導致慢性炎症。因此,靶向這些記憶細胞可能成為治療自身免疫疾病的一個策略。
免疫記憶的研究還涉及到與其他生理系統的相互作用。例如,應激反應和睡眠質量都可能影響免疫記憶的形成和維持。理解這些相互作用有助於開發更全面的策略來增強疫苗效果或改善免疫功能。
近年來,表觀遺傳學在免疫記憶研究中的作用越來越受到重視。研究發現,某些表觀遺傳修飾可能在記憶細胞的形成和維持中發揮重要作用。例如,DNA甲基化和組蛋白修飾的模式可能決定哪些基因在記憶細胞中保持活躍或沉默。這些發現為靶向調節免疫記憶提供了新的思路。
免疫記憶的另一個有趣方面是所謂的"訓練性免疫"(Trained Immunity)。這個概念挑戰了傳統上認為只有適應性免疫系統才具有記憶能力的觀點。研究發現,某些先天免疫細胞,如自然殺手細胞和巨噬細胞,在經歷特定刺激後也能獲得一種"記憶樣"特性,使它們在再次遇到相同或類似刺激時反應更強烈。這種現象為增強整體免疫防禦提供了新的可能性。
免疫記憶的研究還涉及到微生物組的影響。越來越多的證據表明,腸道微生物群可能影響免疫記憶的形成和維持。例如,某些共生菌可能通過產生特定的代謝物來調節記憶T細胞的功能。這些發現不僅深化了我們對免疫記憶的理解,還為通過調節微生物組來增強疫苗效果提供了新的思路。
在疫苗開發領域,理解免疫記憶的機制lead to了多種創新策略。例如,某些研究者正在探索如何設計疫苗以特異性地靶向和活化記憶B細胞,以產生更持久的抗體反應。另一種方法是開發能夠同時刺激多種免疫細胞類型的複合疫苗,以產生更全面的免疫記憶。
免疫記憶的研究還延伸到了癌症免疫治療領域。例如,研究者正在探索如何利用免疫檢查點抑制劑來不僅激活效應T細胞,還促進記憶T細胞的形成,以提供更持久的抗腫瘤效果。此外,理解腫瘤微環境如何影響記憶T細胞的功能,可能lead to新的策略來增強immunotherapy的效果。
在自身免疫疾病研究中,免疫記憶的概念也在不斷演變。例如,某些研究指出,在某些自身免疫疾病中,可能存在針對自身抗原的"病理性"記憶T細胞。這些細胞可能在疾病的復發和慢性化中發揮關鍵作用。因此,特異性地靶向這些病理性記憶細胞,而不是廣泛抑制整個免疫系統,可能成為更精準的治療策略。
免疫記憶的研究還涉及到跨代效應。一些研究表明,父母的免疫經歷可能通過表觀遺傳機制影響後代的免疫反應。這種"免疫印記"的概念為理解某些疾病的遺傳傾向提供了新的視角,也為預防策略的制定提供了新的思路。
免疫記憶是一個複雜而動態的過程,涉及多個細胞類型和分子機制的協同作用。深入理解這些機制不僅有助於我們更好地理解免疫系統的工作原理,還為開發更有效的疫苗和immunotherapy策略提供了重要的理論基礎。隨著研究的深入,我們有望開發出更精準、更持久的免疫干預方法,為多種疾病的預防和治療帶來新的突破。
免疫系統的主要中心是一系列特化的組織和器官,它們負責免疫細胞的產生、成熟、分化和功能執行。這些中心可以broadly分為初級(或中央)淋巴器官和次級(或外周)淋巴器官。初級淋巴器官主要負責免疫細胞的產生和初步選擇,而次級淋巴器官則是免疫反應發生和調節的場所。
骨髓是最重要的初級淋巴器官之一。它是所有血細胞,包括免疫細胞的主要來源。骨髓中的造血幹細胞能夠分化為各種類型的血細胞,包括紅血球、白血球和血小板。在免疫系統中,骨髓負責B細胞的產生和初步選擇。B細胞前體在骨髓中經歷一系列的發育階段,包括重排免疫球蛋白基因以產生多樣化的B細胞受體。在這個過程中,那些對自身抗原有強烈反應的B細胞會被清除或失活,這是中央耐受機制的一部分。
骨髓也是許多其他免疫細胞的發源地。例如,單核細胞、粒細胞和樹突細胞的前體都在骨髓中產生。這些細胞在骨髓中完成初步發育後,會遷移到外周組織中進一步分化和發揮功能。此外,骨髓還是漿細胞的重要棲息地,這些細胞負責長期分泌抗體,維持體液免疫。
胸腺是另一個關鍵的初級淋巴器官,主要負責T細胞的發育和選擇。早期的T細胞前體從骨髓遷移到胸腺,在那裏經歷一系列複雜的發育階段。這個過程包括T細胞受體(TCR)基因的重排,以產生能夠識別多種抗原的T細胞。
在胸腺中,T細胞要經過嚴格的選擇過程。正選擇確保只有那些能夠適度識別自身MHC分子的T細胞存活下來。負選擇則清除那些對自身抗原有強烈反應的T細胞。這個雙重選擇過程是建立中央免疫耐受的關鍵機制,有助於防止自身免疫疾病的發生。
胸腺的結構對T細胞的發育至關重要。它分為皮質和髓質兩個主要區域。在皮質中,未成熟的T細胞(稱為胸腺細胞)與皮質上皮細胞相互作用,進行正選擇。在髓質中,胸腺細胞與髓質上皮細胞和樹突細胞相互作用,進行負選擇。髓質上皮細胞能夠表達一種特殊的轉錄因子AIRE(Autoimmune Regulator),它使這些細胞能夠表達多種組織特異性抗原,這對於建立對這些抗原的中央耐受至關重要。
值得注意的是,胸腺的功能隨年齡增長而逐漸下降。這種現象被稱為胸腺退化(Thymic Involution),它可能部分解釋了為什麼老年人更容易受到某些感染和癌症的影響。然而,即使在成年人中,胸腺仍然保持一定程度的功能,繼續產生新的T細胞,儘管速率大大降低。
次級淋巴器官是免疫反應啟動和調節的主要場所。它們包括淋巴結、脾臟、扁桃體以及與黏膜相關的淋巴組織(MALT),如派爾氏斑(Peyer's Patches)。這些器官為免疫細胞和抗原的相遇提供了理想的環境,促進了有效的免疫反應。
淋巴結是分佈在全身的豆狀結構,它們通過淋巴管連接,形成了一個複雜的網絡。淋巴結的結構高度組織化,包括皮質、副皮質和髓質。B細胞主要聚集在皮質的濾泡中,而T細胞則主要分佈在副皮質區域。這種結構安排有利於B細胞和T細胞的相互作用,促進抗體產生和細胞介導的免疫反應。
淋巴結中還存在特化的細胞,如濾泡樹突細胞(FDC)和T區域樹突細胞。FDC能夠長期保留抗原,這對於B細胞的活化和親和力成熟至關重要。T區域樹突細胞則主要負責向T細胞呈遞抗原,啟動T細胞介導的免疫反應。
脾臟是體內最大的次級淋巴器官,它不僅參與免疫反應,還具有過濾血液和清除老化紅血球的功能。脾臟的結構包括紅髓和白髓。紅髓主要負責過濾血液和清除粒細胞的功能,而白髓則是免疫反應的主要場所。
脾臟的白髓包含T細胞區(又稱為外周動脈淋巴鞘,PALS)和B細胞區(主要是濾泡)。這種結構安排有利於T細胞和B細胞的相互作用,促進有效的免疫反應。脾臟還含有一個特殊的區域稱為邊緣區,這裏富含巨噬細胞和特化的B細胞,能夠快速響應血源性病原體。
黏膜相關淋巴組織(MALT)是另一類重要的次級淋巴器官,它分佈在與外界環境直接接觸的黏膜表面,如呼吸道、消化道和泌尿生殖道。MALT包括多個組成部分,如腸道相關淋巴組織(GALT)、支氣管相關淋巴組織(BALT)等。
在腸道中,派爾氏斑是GALT的重要組成部分。它們位於小腸黏膜下,由濾泡和濾泡間區域組成。濾泡主要含有B細胞,而濾泡間區域則富含T細胞。派爾氏斑上覆蓋著特化的上皮細胞,稱為M細胞,這些細胞能夠將腸腔中的抗原轉運到下方的免疫細胞,啟動免疫反應。
除了這些主要的免疫中心,還有一些特化的免疫組織值得注意。例如,在皮膚中存在一種特殊的免疫結構,稱為皮膚相關淋巴組織(SALT)。這包括表皮中的朗格漢斯細胞、真皮中的T細胞和樹突細胞等。SALT在皮膚免疫防禦和某些皮膚疾病的發病機制中發揮重要作用。
肝臟雖然主要不被視為免疫器官,但它在免疫功能中扮演著重要角色。肝臟含有大量的巨噬細胞(庫普弗細胞)和NK細胞,這些細胞在清除血液中的病原體和異物方面發揮關鍵作用。此外,肝臟還參與產生多種急性期蛋白,這些蛋白在炎症反應中起重要作用。
中樞神經系統(CNS)long被認為是免疫特權部位,但現在我們知道它有自己的特化免疫系統。腦膜、脈絡叢和腦室周圍器官形成了CNS的"免疫監視"系統。此外,小膠質細胞作為CNS的常駐免疫細胞,在神經免疫學中扮演著關鍵角色。
免疫系統的主要中心之間存在複雜的相互作用和協調。例如,在骨髓和胸腺中產生的免疫細胞需要在次級淋巴器官中進一步成熟和活化。同時,次級淋巴器官中發生的免疫反應可能影響初級淋巴器官的功能,如通過反饋機制調節新細胞的產生。
這些免疫中心的功能和結構可能受到多種因素的影響。例如,年齡、營養狀況、應激水準等都可能影響免疫器官的功能。某些疾病或治療(如化療)也可能對這些器官造成顯著影響。理解這些影響對於全面評估個體的免疫功能至關重要。
免疫系統主要中心的研究為多種疾病的診斷和治療提供了重要基礎。例如,某些淋巴瘤的分類和分期就基於它們在不同淋巴器官中的起源和擴散。在器官移植領域,理解這些免疫中心的功能有助於開發更有效的免疫抑制策略。
隨著技術的進步,我們對免疫系統主要中心的理解正在不斷深化。例如,先進的成像技術使我們能夠實時觀察免疫細胞在這些器官中的動態行為。單細胞測序技術則揭示了這些器官中細胞群體的高度異質性。這些新知識不僅豐富了我們對免疫系統的理解,還為開發新的診斷和治療方法提供了機會。
人體抗體是免疫系統中極其重要的一環,它們是由B淋巴細胞產生的特殊蛋白質,能夠識別和中和外來的病原體。抗體在適應性免疫反應中扮演著關鍵角色,為人體提供特異性的防禦機制。
抗體的基本結構呈現出獨特的Y形,由四條多肽鏈組成:兩條相同的重鏈和兩條相同的輕鏈。這些鏈通過雙硫鍵連接在一起,形成了抗體分子的特徵性結構。Y形結構的上端是抗原結合部位,也稱為可變區(variable region),它決定了抗體的特異性。每個抗體分子都有兩個相同的抗原結合位點,使其能夠同時結合兩個相同的抗原分子。
抗體分子的下端稱為恆定區(constant region),它決定了抗體的功能和類型。根據恆定區的結構差異,抗體可以分為五大類:免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。每種類型的抗體在免疫防禦中發揮著不同的作用。
IgG是血液中最豐富的抗體,也是唯一能夠穿過胎盤的抗體,為新生兒提供被動免疫。IgA主要存在於黏膜分泌物中,如唾液和腸道分泌物,負責保護黏膜表面。IgM是最早產生的抗體,在初次免疫應答中起重要作用。IgD主要存在於B細胞表面,其確切功能尚不完全清楚。IgE與過敏反應和抵抗寄生蟲感染有關。
抗體通過多種機制發揮其保護作用。首先,抗體可以直接中和病原體,阻止其與宿主細胞結合。其次,抗體可以標記病原體,促進吞噬細胞的識別和吞噬過程,這一過程稱為調理作用(opsonization)。此外,抗體還可以激活補體系統,引發一系列的免疫反應,最終導致病原體的裂解。
在免疫記憶中,抗體也扮演著重要角色。當機體再次遇到相同的抗原時,記憶B細胞可以迅速分化並產生大量的特異性抗體,從而提供更快速、更有效的免疫保護。
總之,抗體是人體免疫系統中不可或缺的組成部分,通過其特異性結合和多樣化的功能,為機體抵抗各種病原體入侵提供了強大的防禦屏障。深入理解抗體的結構、功能和作用機制,對於開發疫苗、治療自身免疫疾病以及設計新型免疫療法都具有重要意義。
抗體的結構是一個精密而複雜的生物分子系統,它的獨特設計使其能夠高效地識別和中和各種外來入侵者。深入了解抗體的結構不僅有助於我們理解免疫系統的運作機制,還為開發新型疫苗和治療方法提供了重要的理論基礎。
抗體分子的基本結構呈現出特徵性的Y形,這種形狀不僅優雅,更是功能的完美體現。整個抗體分子由四條多肽鏈組成:兩條完全相同的重鏈和兩條完全相同的輕鏈。這四條鏈通過共價鍵(主要是雙硫鍵)和非共價相互作用緊密結合在一起,形成了一個穩定而靈活的整體。
重鏈是抗體結構的主幹,通常由大約440個氨基酸組成。每條重鏈可以分為四個區域:一個可變區(VH)和三個恆定區(CH1、CH2和CH3)。輕鏈則相對較短,約由220個氨基酸組成,分為一個可變區(VL)和一個恆定區(CL)。重鏈和輕鏈的可變區共同構成了抗體的抗原結合位點,也就是能夠特異性識別和結合抗原的部位。
抗體分子的Y形結構可以進一步細分為三個主要功能區域:兩個相同的抗原結合片段(Fab,Fragment antigen-binding)和一個結晶片段(Fc,Fragment crystallizable)。每個Fab片段由一條重鏈的VH和CH1區域與一條完整的輕鏈組成。Fab片段的頂端形成了抗原結合位點,這裡的氨基酸序列呈現出高度變異性,使得不同的抗體能夠識別各種不同的抗原。Fc片段則由兩條重鏈的CH2和CH3區域組成,它決定了抗體的生物學功能,如與免疫細胞上的Fc受體結合或激活補體系統。
在分子水準上,抗體的可變區包含了決定抗原特異性的互補決定區(CDRs,Complementarity-determining regions)。每條重鏈和輕鏈的可變區各包含三個CDRs(分別稱為CDR1、CDR2和CDR3),這六個CDRs共同形成了抗原結合位點的核心。CDRs的氨基酸序列變異性極高,這種變異性是抗體能夠識別幾乎無限多種抗原的基礎。
抗體分子中的鉸鏈區(hinge region)位於CH1和CH2區域之間,它賦予了抗體分子極大的靈活性。鉸鏈區允許兩個Fab臂在空間上相對自由地移動,使得抗體能夠更有效地與不同空間排布的抗原結合。這種靈活性對於抗體執行其生物學功能至關重要,例如在交聯抗原或與細胞表面受體結合時。
抗體分子的恆定區,尤其是Fc部分,在決定抗體的效應功能方面起著關鍵作用。Fc區域可以與免疫系統中的各種效應分子和細胞相互作用,包括補體蛋白、巨噬細胞和自然殺手細胞等。這些相互作用觸發了一系列的免疫反應,如補體依賴的細胞毒性、抗體依賴的細胞介導的細胞毒性等。
在抗體的生物合成過程中,B淋巴細胞通過一系列複雜的基因重排和突變過程產生多樣化的抗體分子。這個過程涉及到免疫球蛋白基因的V(可變)、D(多樣性)和J(連接)片段的重排,以及隨後的體細胞高頻突變。這種精密的基因調控機制確保了抗體庫的多樣性,使得免疫系統能夠應對幾乎所有可能遇到的外來抗原。
抗體分子還經歷後轉譯修飾,其中最重要的是糖基化。糖基化主要發生在Fc區域的CH2結構域上,這些糖基不僅影響抗體的穩定性和半衰期,還調節著抗體的效應功能。例如,某些特定的糖基化模式可以增強抗體與Fc受體的親和力,從而增強抗體介導的細胞毒性作用。
抗體的三級結構也值得關注。每個結構域(無論是可變區還是恆定區)都採取了特徵性的免疫球蛋白折疊(immunoglobulin fold)。這種折疊結構由兩層β片層組成,每層包含3-4個反平行β鏈。這種緊密的折疊不僅確保了抗體結構的穩定性,還為抗原結合和效應功能提供了理想的分子基礎。
值得一提的是,抗體結構的多樣性不僅體現在氨基酸序列的變異上,還反映在不同類型抗體之間的結構差異上。例如,IgM抗體通常以五聚體形式存在,每個單體通過J鏈(joining chain)連接;而分泌型IgA則常以二聚體形式出現,同樣依賴J鏈連接。這些高級聚合體結構賦予了不同類型的抗體獨特的生物學特性和功能。
抗體結構的研究對現代醫學和生物技術產生了深遠的影響。基於對抗體結構的深入理解,科學家們開發出了各種工程化抗體,如嵌合抗體、人源化抗體和全人源抗體等。這些工程化抗體在降低免疫原性的同時,保留或甚至增強了原有抗體的治療效果。此外,單域抗體(nanobodies)、雙特異性抗體等新型抗體分子的設計和開發,都是建立在對天然抗體結構深刻理解的基礎之上。
抗體的結構是一個精妙複雜的系統,它完美地將功能和形態統一起來。從分子層面上的氨基酸排列,到結構域的組織,再到整體的Y形構型,每一個層次都體現了進化的智慧。深入理解抗體結構不僅有助於我們揭示免疫系統的奧秘,還為開發新一代的診斷工具和治療方法提供了重要的理論基礎和實踐指導。隨著研究技術的不斷進步,我們對抗體結構的認識也在不斷深化,這無疑將推動免疫學和生物醫學領域取得更多突破性的進展。
抗體是免疫系統中至關重要的組成部分,它們在人體防禦機制中扮演著多樣化的角色。根據重鏈的結構差異,抗體可以分為五種主要類型:免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。每種類型的抗體都有其獨特的結構特徵和功能,共同構成了人體強大而靈活的體液免疫防禦網絡。
免疫球蛋白G(IgG)是血清中含量最豐富的抗體類型,約佔血清抗體總量的75-80%。IgG是一種單體抗體,分子量約為150 kDa。它的結構最為典型,呈現出特徵性的Y字形。IgG可以進一步分為四個亞類:IgG1、IgG2、IgG3和IgG4,它們在結構和功能上略有差異。IgG是唯一能夠穿過胎盤的抗體,因此在新生兒的被動免疫中起著關鍵作用。此外,IgG還具有中和毒素、病毒和細菌的能力,可以激活補體系統,並通過與巨噬細胞和自然殺手細胞上的Fc受體結合來促進吞噬作用和抗體依賴的細胞介導的細胞毒性(ADCC)。IgG的半衰期最長,可達23天,這使得它能夠提供長期的免疫保護。
免疫球蛋白A(IgA)是黏膜表面和外分泌液中最主要的抗體類型。在血清中,IgA以單體形式存在,而在分泌物中,如唾液、淚液、母乳和腸道分泌物中,IgA主要以二聚體形式存在。分泌型IgA(sIgA)由兩個IgA單體通過J鏈(joining chain)連接,並與分泌片(secretory component)結合而成。這種特殊的結構使得sIgA能夠抵抗蛋白酶的消化,從而在黏膜表面發揮持久的保護作用。IgA主要通過阻止病原體附著和中和毒素來保護黏膜表面,它不激活補體系統,因此不會引起炎症反應,這對於維護黏膜表面的完整性非常重要。
免疫球蛋白M(IgM)是在原發性免疫應答中最早產生的抗體。它在血清中以五聚體形式存在,分子量約為900 kDa,是最大的抗體分子。五個IgM單體通過J鏈連接成一個環狀結構,因此每個IgM分子具有10個抗原結合位點。這種多價結構使得IgM在識別和結合抗原方面非常高效,特別是對多價抗原如細菌表面的多糖。IgM是補體系統的強效激活劑,在早期免疫應答中發揮著重要作用。雖然IgM的親和力相對較低,但由於其高度的價數,使得它具有很強的功能親和力(avidity)。IgM也存在於成熟B細胞的表面,作為抗原受體參與B細胞的活化過程。
免疫球蛋白D(IgD)是一種相對較少被研究的抗體類型。它主要以膜結合形式存在於成熟B細胞的表面,與IgM共同作為B細胞抗原受體。血清中的IgD含量很低,其確切功能尚未完全闡明。近年來的研究表明,IgD可能在黏膜免疫和某些自身免疫疾病中發揮作用。膜結合形式的IgD參與B細胞的抗原識別和活化過程,可能在調節B細胞的發育和功能方面起重要作用。
免疫球蛋白E(IgE)是血清中含量最少的抗體類型,但在過敏反應和抗寄生蟲感染中起著關鍵作用。IgE可以與肥大細胞和嗜鹼性粒細胞表面的高親和力IgE受體(FcεRI)結合。當過敏原(抗原)與細胞表面的IgE交聯時,會觸發這些細胞釋放組胺等炎症介質,導致過敏症狀。儘管IgE在過敏反應中的作用常被視為不利的,但它在抵抗某些寄生蟲感染方面發揮著重要的保護作用。IgE的半衰期很短,只有2-3天,這可能是機體調節其水準以避免過度炎症反應的一種機制。
每種抗體類型都有其獨特的重鏈恆定區結構。IgG、IgA和IgD的重鏈包含三個恆定區域(CH1、CH2和CH3),而IgM和IgE的重鏈則包含四個恆定區域(CH1、CH2、CH3和CH4)。這些結構上的差異決定了不同類型抗體與效應分子和細胞的相互作用方式,從而影響其生物學功能。
抗體類型轉換(class switching)是B細胞發育過程中的一個重要事件。在初次免疫應答中,活化的B細胞最初產生IgM和IgD。隨後,在T細胞的幫助下,B細胞可以通過基因重組過程改變重鏈恆定區的表達,從而產生其他類型的抗體,如IgG、IgA或IgE。這種類型轉換使得免疫系統能夠產生具有相同抗原特異性但不同效應功能的抗體,從而更好地適應不同的免疫挑戰。
在某些情況下,一種抗體類型可能比其他類型更為重要。例如,在黏膜免疫中,IgA起著主導作用;在過敏反應中,IgE是關鍵參與者;而在系統性細菌感染中,IgG和IgM則發揮著主要作用。這種功能上的分工使得免疫系統能夠針對不同類型的病原體和不同的感染部位提供最適當的防禦。
此外,不同類型的抗體在體內的分佈也有所不同。IgG主要分佈在血液和組織間液中,IgA主要存在於黏膜分泌物中,IgM主要存在於血液中,IgD主要存在於B細胞表面,而IgE則主要與肥大細胞和嗜鹼性粒細胞結合。這種分佈上的差異反映了各種抗體類型在不同生理環境中的特定功能。
了解不同類型抗體的特性對於疾病診斷和治療具有重要意義。例如,在某些感染性疾病的診斷中,檢測特異性IgM可以指示近期感染,而特異性IgG則可能表明既往感染或疫苗接種史。在自身免疫疾病中,不同類型的自身抗體可能與不同的疾病表現相關。在過敏性疾病的診斷和治療中,IgE水準的測定和調控是關鍵。
在生物技術和製藥領域,對不同抗體類型的理解和利用也取得了顯著進展。例如,單克隆抗體技術的發展使得可以大量生產特定類型和特異性的抗體。這些抗體可用於疾病診斷、靶向治療和基礎研究。通過基因工程技術,科學家們還可以設計和製造具有特定功能的人源化或全人源抗體,這些抗體在腫瘤免疫治療、自身免疫疾病治療等領域顯示出巨大潛力。
總之,抗體的多樣性不僅體現在其抗原特異性上,還體現在不同類型抗體的結構和功能特點上。這種多樣性為免疫系統提供了應對各種免疫挑戰的靈活性和效能。深入理解各種抗體類型的特性及其在免疫防禦中的作用,不僅有助於我們更好地理解免疫系統的工作原理,還為開發新的診斷和治療策略提供了重要的理論基礎和實踐指導。
免疫系統是人體抵禦外來病原體和維持內環境穩定的重要防線。然而,這個複雜而精密的系統有時也會出現異常,導致各種免疫相關疾病。免疫系統的破壞可以分為幾個主要類型:免疫缺陷、自身免疫疾病、過敏反應和慢性炎症。這些異常狀態不僅影響人體的正常防禦功能,還可能對健康造成嚴重威脅。
免疫缺陷是指免疫系統的一個或多個組成部分功能減弱或缺失,導致機體無法有效抵抗感染。這種情況可分為先天性免疫缺陷和獲得性免疫缺陷。先天性免疫缺陷通常由基因突變引起,如嚴重聯合免疫缺陷症(SCID)、慢性肉芽腫病(CGD)等。這些患者從出生開始就可能反覆感染各種病原體,甚至普通的感冒病毒都可能造成嚴重後果。獲得性免疫缺陷則可能由多種因素導致,最著名的例子是人類免疫缺陷病毒(HIV)感染導致的獲得性免疫缺陷綜合症(AIDS)。HIV病毒攻擊並破壞T輔助細胞,最終導致整個免疫系統崩潰,患者極易受到機會性感染和某些癌症的侵襲。
此外,某些藥物治療(如化療和免疫抑制劑)、營養不良、慢性疾病和衰老等因素也可能導致免疫功能下降。例如,長期使用皮質類固醇可抑制多種免疫細胞的功能,增加感染風險。在這些情況下,患者需要特別注意預防感染,可能需要接受預防性抗生素治療或免疫球蛋白替代療法。
自身免疫疾病是另一類重要的免疫系統紊亂。在這種情況下,免疫系統錯誤地將自身組織識別為外來物質並發動攻擊,導致組織損傷和功能障礙。自身免疫疾病可以影響身體的任何部位,從單一器官到全身性疾病。常見的自身免疫疾病包括類風濕性關節炎、系統性紅斑狼瘡、多發性硬化症、I型糖尿病等。
自身免疫疾病的發病機制複雜,通常涉及遺傳因素和環境因素的相互作用。例如,在類風濕性關節炎中,某些HLA基因的變異與疾病易感性相關,而吸煙等環境因素可能觸發疾病的發生。自身抗體的產生是許多自身免疫疾病的特徵,這些抗體可以直接損傷靶組織或形成免疫複合物沉積在組織中,引發炎症反應。
T細胞介導的自身反應也在許多自身免疫疾病中扮演重要角色。例如,在I型糖尿病中,自身反應性T細胞攻擊胰腺β細胞,導致胰島素分泌不足。自身免疫疾病的治療通常需要長期免疫抑制,這增加了患者感染和某些惡性腫瘤的風險。因此,在治療過程中需要仔細權衡利弊,並密切監測患者的整體健康狀況。
過敏反應是免疫系統對通常無害的物質(過敏原)產生的不適當或過度反應。過敏反應可分為四種類型,其中最常見的是I型超敏反應,又稱即時型過敏反應。這種反應由IgE抗體介導,當過敏原與肥大細胞或嗜鹼性粒細胞表面的IgE交聯時,這些細胞釋放組胺等炎症介質,導致過敏症狀。
常見的過敏性疾病包括花粉症、食物過敏、哮喘和蕁麻疹等。過敏反應的嚴重程度可以從輕微的皮膚發癢到威脅生命的過敏性休克。某些個體可能對多種過敏原敏感,這種情況稱為多重過敏。過敏性疾病的發病與遺傳因素、環境暴露和生活方式密切相關。例如,衛生假說提出,過度清潔的生活環境可能導致免疫系統發育不全,增加過敏性疾病的風險。
過敏性疾病的管理通常包括避免接觸過敏原、藥物治療(如抗組胺藥、皮質類固醇)和免疫療法。免疫療法,如過敏原特異性免疫治療,通過逐漸增加過敏原劑量來誘導免疫耐受,可能改變疾病的自然進程。然而,這種治療需要長期堅持,且並非對所有患者都有效。
慢性炎症是另一種常見的免疫系統紊亂,它可能由持續的感染、自身免疫反應或環境因素引起。與急性炎症不同,慢性炎症可持續數月甚至數年,導致組織損傷和功能障礙。慢性炎症與多種疾病相關,包括動脈粥樣硬化、2型糖尿病、某些癌症和神經退行性疾病。
在慢性炎症中,免疫細胞持續活化,分泌各種炎症因子,如腫瘤壞死因子α(TNF-α)、白介素-6(IL-6)等。這些因子不僅維持炎症狀態,還可能影響其他生理過程,如代謝和神經功能。例如,在肥胖相關的慢性炎症中,脂肪組織中的巨噬細胞分泌炎症因子,導致胰島素抵抗和2型糖尿病的發生。
慢性炎症的治療策略包括控制原發疾病、抗炎藥物治療和生活方式干預。例如,在類風濕性關節炎中,抗風濕藥物可以抑制關節炎症,減緩疾病進展。而在代謝性疾病相關的慢性炎症中,飲食調整和運動等生活方式干預可能有助於減輕炎症負擔。
免疫系統紊亂還可能導致某些惡性腫瘤的發生。一方面,免疫缺陷狀態增加了某些癌症的風險,如AIDS患者易發生卡波西肉瘤。另一方面,慢性炎症可能促進腫瘤的發生和發展,如慢性B型肝炎病毒感染與肝細胞癌的關係。此外,某些腫瘤細胞可能通過多種機制逃避免疫監視,如下調MHC分子表達、分泌免疫抑制因子等。
近年來,腫瘤免疫治療的發展為癌症治療帶來了新的希望。例如,免疫檢查點抑制劑通過阻斷PD-1/PD-L1或CTLA-4等抑制性信號,增強T細胞對腫瘤的殺傷作用。CAR-T細胞療法則通過基因工程技術使T細胞表達特定的腫瘤抗原受體,增強其識別和殺傷腫瘤細胞的能力。這些治療方法在某些癌症中取得了顯著效果,但也可能引發嚴重的免疫相關不良反應,需要密切監測和管理。
免疫系統紊亂的診斷和治療是一個復雜的過程,需要綜合考慮臨床表現、實驗室檢查和影像學檢查等多方面因素。例如,自身抗體檢測對自身免疫疾病的診斷具有重要價值,而過敏原特異性IgE檢測可幫助確定過敏原。新興的技術,如流式細胞術、單細胞測序等,為深入研究免疫系統功能和紊亂提供了強有力的工具。
隨著對免疫系統功能和調控機制認識的深入,針對免疫系統紊亂的治療策略也在不斷發展。除了傳統的免疫抑制和抗炎治療外,靶向特定免疫通路的生物製劑,如抗TNF-α藥物、IL-6受體拮抗劑等,在自身免疫疾病和炎症性疾病的治療中發揮重要作用。基因治療和幹細胞治療也為某些免疫缺陷疾病和自身免疫疾病提供了新的治療可能。
在預防和管理免疫系統紊亂方面,生活方式干預和環境控制也起著重要作用。例如,均衡飲食、規律運動、充足睡眠等有助於維持免疫系統的正常功能。對於過敏性疾病,識別和避免過敏原是關鍵的預防策略。此外,疫苗接種不僅可以預防特定的感染性疾病,還可能通過調節免疫系統功能影響某些免疫相關疾病的發生和發展。